题目内容
2.某小组拟用含稀硫酸的KMnO4溶液与H2C2O4溶液(弱酸)的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,并设计了如表的方案记录实验结果(忽略溶液混合体积变化).限选试剂和仪器:0.20 mol/LH2C2O4溶液、0.010mol/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽| 物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | M(MnSO4 固体)/g | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 0 | 25 | |
| ③ | 1.0 | a | 4.0 | 0 | 25 | |
| ④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
(1)完成上述反应原理的化学反应方程式:5H2C2O4+2KMnO4+3H2SO4═10CO2↑+2MnSO4+K2SO4+8H2O
(2)上述实验①②是探究温度对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a为1.0;乙是实验需要测量的物理量,则表格中“乙”应填写t溶液褪色时间/s.上述实验②④是探究催化剂对化学反应速率的影响.
(3)已知草酸为二元弱酸,其两级的电离方程式分别为:H2C2O4?HC2O4-+H+、HC2O4-?C2O42-+H+;
(4)为了观察紫色褪去,草酸与高锰酸钾初始的物质的量需要满足的关系
n(H2C2O4):n (KMnO4)最小为:2.5(或5:2).
分析 (1)酸性高锰酸钾是用稀硫酸酸化,混合溶液发生氧化还原反应,KMnO4被还原为MnSO4,H2C2O2被氧化为CO2,根据得失电子数守恒和原子守恒写出反应方程式;
(2)当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致;要探究H2C2O4溶液浓度不同对反应速率的影响,则加入的H2C2O4溶液的体积不同,但反应体积溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积均为6mL;要准确描述反应速率的快慢,必须准确测得溶液褪色时间的长短;④中加了MnSO4固体,锰离子对该反应起催化作用;
(3)草酸是二元弱酸,应分步电离;
(4)为了观察到紫色褪去,草酸应该稍微过量.
解答 解:(1)酸性高锰酸钾是用稀硫酸酸化,H2SO4、KMnO4与H2C2O2发生反应,KMnO4被还原为MnSO4,化合价降低5价,H2C2O2被氧化为CO2,每个C原子的化合价升高1价,1个H2C2O2升高2价,则高锰酸钾与草酸计量数之比为2:5,根据原子守恒配平可得:5H2C2O4+2KMnO4+3H2SO4═10CO2↑+2MnSO4+K2SO4+8H2O,
故答案为:5H2C2O4+2KMnO4+3H2SO4═10CO2↑+2MnSO4+K2SO4+8H2O;
(2)当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致,通过比较实验①②的反应条件可知,实验①②可探究温度对反应速率的影响;实验②③中的H2C2O4溶液的加入体积不同,故要探究H2C2O4溶液浓度不同对反应速率的影响,但反应体积溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积均为6.0mL,则a的值为1.0;要准确描述反应速率的快慢,必须准确测得溶液褪色时间的长短,故乙要测量的物理量是溶液褪色的时间(t溶液褪色时间/s);其他条件相同,④中加了MnSO4固体,锰离子对该反应起催化作用,则②④探究的是催化剂对反应速率的影响,
故答案为:温度;1.0;t溶液褪色时间/s;催化剂;
(3)草酸(H2C2O4)是一种二元弱酸,分步电离,电离方程式为H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-,
故答案为:H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-;
(4)高锰酸钾和草酸反应方程式为5H2C2O4+2KMnO4+3H2SO4═10CO2↑+2MnSO4+K2SO4+8H2O,为了观察到紫色褪去,草酸应该稍微过量,所以n(H2C2O4):n(KMnO4)≥2.5,
故答案为:2.5(或5:2).
点评 本题考查了弱酸的电离方程式书写、氧化还原反应方程式书写以及影响化学反应速率因素的实验探究,对于影响反应速率的因素的探究,应注意的是当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致,难度中等.

| A. | X属于非金属元素 | B. | 对应的氢化物的热稳定性:W>Y | ||
| C. | W与Z易于形成离子化合物 | D. | Z离子的氧化性强于X离子 |
| A. | Cu+2HCl═CuCl2+H2↑ | B. | Al2O3+3H2O═2Al(OH)3 | ||
| C. | Mg(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ MgO+H2O | D. | Ba(OH)2+SO2═BaSO4↓+H2O |
| A. | △H>0表示放热反应,△H>0表示吸热反应 | |
| B. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 | |
| C. | 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热量叫做中和热 | |
| D. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/(g•cm-3) | 0.789 3 | 1.460 4 | 0.809 8 | 1.275 8 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(2)将1-溴丁烷粗产品置于分液漏斗中,加水振荡后静置,产物在下层(填“上层”“下层”或“不分层”).
(3)制备操作中,加入的浓硫酸必须进行稀释,其目的是ABC(填字母).
A.减少副产物烯和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是C(填字母).
A.NaI B.NaOH C.NaHSO3 D.KCl
(5)在制备溴乙烷时,采用边反应边蒸馏产物的方法,目的是:平衡向生成溴乙烷的方向移动(或反应②向右移动)
但在制备1-溴丁烷时却不能边反应边蒸馏,其原因:1-溴丁烷和正丁醇的沸点相差不大.
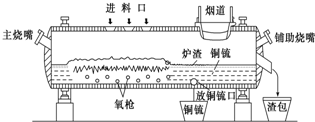
 随着工业发展和社会的进步,人们日益关注环境污染问题.
随着工业发展和社会的进步,人们日益关注环境污染问题.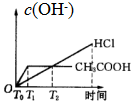
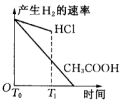

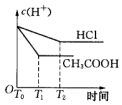
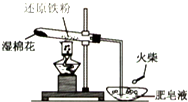 为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.
为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.