题目内容
2.能正确表示下列反应的离子方程式的是( )| A. | 石灰石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | Na2C03溶液显碱性:C032-+H2O═HCO3-+OH- | |
| C. | 过量铁屑溶于稀硝酸:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| D. | FeI2溶液中通入少量氯气:2Fe2++C12═2Fe3++2Cl- |
分析 A.碳酸钙和醋酸都不能拆开,应该保留化学式;
B.碳酸根离子部分水解生成碳酸氢根离子和氢氧根离子,该反应为可逆反应,应该用可逆号;
C.铁粉过量,反应生成硝酸亚铁、NO气体和水;
D.亚铁离子的还原性小于碘离子,氯气少量时碘离子优先反应.
解答 解:A.醋酸和碳酸钙都应该保留化学式,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故A错误;
B.碳酸根离子部分水解,导致Na2CO3溶液显碱性,该反应为可逆反应,正确的反应为:CO32-+H2O?HCO3-+OH-,故B错误;
C.过量铁粉与稀硝酸反应生成硝酸亚铁,反应的离子方程式为:Fe+4H++NO3-═Fe3++NO↑+2H2O,故C正确;
D.FeI2溶液中通入少量氯气,碘离子优先被氧化,正确的离子方程式为:2I-+C12═I2+2Cl-,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
12.根据CH2═CH-CH2COOH的结构,它不可能具有的性质是( )
| A. | 与新制氢氧化铜反应 | |
| B. | 使溴的四氯化碳溶液褪色 | |
| C. | 与乙醇在浓硫酸催化下发生酯化反应 | |
| D. | 与银氨溶液反应析出银 |
10.必须加入氧化剂才能实现的变化是( )
| A. | MnO4-→Mn2+ | B. | NaOH→NaCl | C. | KClO3→O2 | D. | CO→CO2 |
17.利用工厂废弃的合金制得氯化铝固体、硝酸铜晶体和铁红的生产流程如图,下列叙述错误的是( )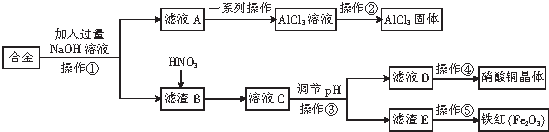

| A. | 滤液A中的溶质主要是NaAlO2和NaOH | |
| B. | 调pH时,可以加入CuO或Cu2(OH)2CO3 | |
| C. | 操作②是在蒸发皿中直接蒸干水分 | |
| D. | 该合金中含有的金属主要为铁、铜、铝 |
7. 已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
 已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )| A. | 若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到白色沉淀产生 | |
| B. | 若A为铁,则足量A与X在室温下即可完全反应 | |
| C. | X使蔗糖变黑的现象主要体现了X的脱水性 | |
| D. | 工业上,B转化为D的反应条件为高温、常压、使用催化剂 |
11.下列实验中,可用如图所示装置进行的是( )
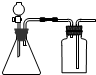

| A. | 将双氧水(H2O2)滴到MnO2中制取O2 | B. | 将浓盐酸滴到浓硫酸中制取HCl | ||
| C. | 将浓氨水滴到生石灰(CaO)中制取NH3 | D. | 将稀硫酸滴到锌粒上中制取H2 |
12.下列表示对应化学反应的离子方程式正确的是( )
| A. | Fe3O4与足量稀 HNO3 反应:Fe3O4+8H+=2Fe3++Fe2++4H2O | |
| B. | 用小苏打治疗胃酸过多:NaHCO3+H+=Na++CO2↑+H2O | |
| C. | 双氧水中加入稀硫酸和 KI 溶液:H2O2+2H++2I-=I2+2H2O | |
| D. | 往碳酸氢钙溶液中滴入少量氢氧化钠溶液:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |