题目内容
11.A、B、C、D、E五种元素的原子序数依次增大,A原子无中子,B的单质在空气中含量最多,C、D元素同主族且原子序数D为C的二倍,E元素的价电子排布式为(n-l)dn+6ns1.回答下列问题:(1)元素B在周期表中的位置是第二周期ⅤA族;E元素的元素符号为Cu,它能形成E+的原因为4s轨道全空,而3d全满符合洪特规则比较稳定.
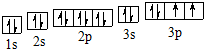
(2)D元素基态原子的核外电子轨道排布图为
 .
.(3)A元素与C元素形成两种常见的化合物,其原子个数比分别为2:1和1:1,两种化合物可以任意比互溶,原因是H2O与H2O2之间形成氢键;其中一种化合物可在酸性条件下将KMnO4还原为Mn2+,相关反应的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O.
分析 A、B、C、D、E五种元素的原子序数依次增大,A原子无中子,则A为H元素;B的单质在空气中含量最多,则B为N;C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu,据此进行解答.
解答 解:A、B、C、D、E五种元素的原子序数依次增大,A原子无中子,则A为H元素;B的单质在空气中含量最多,则B为N;C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu,
(1)B为N元素,原子序数为7,处于周期表中第二周期VA族;E为Cu元素,根据其外围电子排布为3d104sl可知4s轨道全空,而3d全满符合洪特规则比较稳定,所以能够形成Cu+,
故答案为:第二周期VA族;Cu;4s轨道全空,而3d全满符合洪特规则比较稳定;
(2)D为S元素,S原子核外有16个电子,分3层排布,其其电子排布图为: ,
,
故答案为: ;
;
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,分别为H2O与H2O2,由于H2O与H2O2之间形成氢键,两种化合物可任意比互溶;
过氧化氢能被酸性高锰酸钾氧化生成氧气,该反应的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O;
故答案为:H2O与H2O2之间形成氢键;2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.

 名校课堂系列答案
名校课堂系列答案| A. | Cu与Cu20的物质的量之比为2:1 | |
| B. | 硝酸的物质的量浓度为2.4mol/L | |
| C. | 产生的NO在标准状况下的体枳为4.48L | |
| D. | Cu、Cu20与硝酸反应后剩余HN03为lmol |
| A. | 36 | B. | 30 | C. | 66 | D. | 60 |
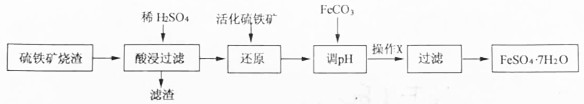
已知:①活化硫铁矿还原Fe3+的反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4
②几种金属阳离子的氢氧化物沉淀时的pH如表所示
| Fe3+ | Al3+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 |
(2)检验“还原“步骤中Fe3+是否被完全还原,应选择C(填字母编号)
A、KMnO4溶液 B、NaOH溶液 C、KSCN溶液
(3)加FeCO3调节溶液pH至5.2~6.5(填pH范围)其目的是除去铝离子,防止生成氢氧化亚铁沉淀
(4)操作X的名称是搅拌、静置.
| A. | 4FeS2( s)+11O2( g)═2Fe2O3( s)+8SO2(g)△H=-3414.8kJ•moL | |
| B. | FeS2(s)+$\frac{11}{4}$O2(g)═$\frac{1}{2}$Fe2O3 (s)+2SO2(g)△H=-853.7kJ•moL | |
| C. | 4FeS2(s)+11O2(g)═2 Fe2O3 (s)+8SO2(g)△H+3414.8kJ•moL | |
| D. | FeS2(s)+$\frac{11}{4}$O2(g)═$\frac{1}{2}$Fe2O3 (s)+2SO2(g)△H=+853.7kJ•moL |
| A. | 高压有利于氨的合成 | |
| B. | 向含有酚酞的氨水溶液中,加入少量NH4Cl晶体,溶液红色变浅 | |
| C. | 常温下,0.1 mol•L-1的盐酸中,由水产生的c(H+)<1.0×10-7mol•L-1 | |
| D. | 使用催化剂可加快SO2转化为SO3的反应速率 |
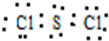 .
.