题目内容
4.有关物质间转化关系如下图,试回答: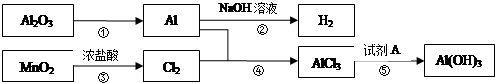
(1)转化①的反应条件为融熔、电解.
(2)转化②的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3)若转化⑤用于实验室制Al(OH)3,则试剂A宜选择氨水(填名称).
(4)向40mL 3mol•L-1 AlCl3溶液中滴加1mol•L-1 NaOH溶液,结果Al3+离子有$\frac{1}{2}$转化为Al(OH)3沉淀,则加入的NaOH溶液的体积可能为180或420mL.
分析 1)利用电解熔融的氧化铝可以制取金属铝;
(2)金属铝能够和强碱反应生成NaAlO2和水;
(3)氢氧化铝溶于强碱溶液,不溶于弱碱,故制取氢氧化铝选用的是弱碱氨水;
(4)Al3+离子有$\frac{1}{2}$转化为Al(OH)3沉淀,存在两种情况,一种是氢氧化钠溶液不足,恰好生成氢氧化铝;一种是氢氧化钠稍过量,生成的沉淀$\frac{1}{2}$反应了,剩余$\frac{1}{2}$没有反应.
解答 解:(1)转化①的反应条件为:融熔、电解,故答案为:融熔、电解;
(2)金属铝和强碱反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)由于氢氧化铝溶于强碱溶液,故制取时选用弱碱氨水,故答案是:氨水;
(4)n(AlCl3)=0.04L×3mol•L-1=0.12mol,生成的Al(OH)3沉淀为0.06mol;
第一种情况:氢氧化钠不足,只生成了氢氧化铝,n(NaOH)=3n(Al(OH)3)=0.18mol,加入的NaOH溶液的体积为 $\frac{0.18mol}{1mol•{L}^{-1}}$=0.18L=180mL;
第二种情况:氢氧化钠部分过量,生成了0.06mol氢氧化铝,0.06mol的NaAlO2,根据反应:Al3++30H-═Al(OH)3 Al(OH)3+0H-═AlO2 -+2H2O、
Al3++40H-═AlO2 -+2H2O;
n(NaOH)=0.06mol×4+0.06mol×3=0.42mol,NaOH溶液的体积为$\frac{0.42mol}{1mol•{L}^{-1}}$=0.42L=420nL;
故答案为:180或420.
点评 本题考查铝的制取、氢氧化铝的制取、氢氧化铝的两性等知识,注意浓盐酸书写离子方程式时写成离子形式,难度中等.

| A. | 需要加热才发生的化学反应,反应物的总能量可能高于生成物的总能量 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1,说明金刚石更稳定 |
| A. | 1:9 | B. | 1:1 | C. | 1:2 | D. | 1:4 |
| A. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | 向三氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═A1(OH)3↓+3NH4+ | |
| C. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 石灰石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O |
 现.
现.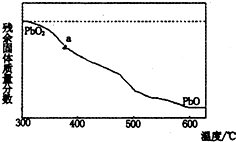 (1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3