题目内容
用标准浓度的盐酸滴定未知浓度的NaOH溶液,下列各操作(其他操作正确)中会造成测定结果偏低的是( )
| A、酸式滴定管尖嘴部分有气泡,滴定后消失 |
| B、滴定终点读数时俯视读数 |
| C、用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 |
| D、锥形瓶水洗后未干燥 |
考点:中和滴定
专题:
分析:根据c(待测)=
分析不当操作对相关物理量的影响,以此判断浓度的误差.
| c(标准)×V(标准) |
| V(待测) |
解答:
解:A.酸式滴定管尖嘴部分有气泡,滴定后消失,尖嘴处的液体的体积被计算到反应消耗的盐酸的体积中,造成V(酸)偏大,导致滴定浓度偏大,故A错误;
B.滴定终点读数时,俯视滴定管的刻度,导致标准液体积偏小,则测定结果偏低,故B正确;
C.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定,酸式滴定管中含有蒸馏水,导致标准溶液的浓度偏小,则滴定时消耗的标准溶液盐酸的体积偏大,导致测得结果偏大,故C错误;
D.锥形瓶无需润洗,锥形瓶水洗后未干燥,对实验结果无影响,故D错误.
故选B.
B.滴定终点读数时,俯视滴定管的刻度,导致标准液体积偏小,则测定结果偏低,故B正确;
C.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定,酸式滴定管中含有蒸馏水,导致标准溶液的浓度偏小,则滴定时消耗的标准溶液盐酸的体积偏大,导致测得结果偏大,故C错误;
D.锥形瓶无需润洗,锥形瓶水洗后未干燥,对实验结果无影响,故D错误.
故选B.
点评:本题主要考查酸碱滴定实验的基本操作,侧重于学生的分析能力和实验能力的考查,难度不大,学生应注意操作的规范性和实验中常见的误差分析.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作导致结果偏低的是( )
| A、酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸 |
| B、锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
| C、滴定前,没有逐出酸式滴定管尖嘴处的气泡,滴定终点时气泡消失 |
| D、滴定前读数正确,达到滴定终点后,俯视读数 |
Na2CO3、KAlO2、Na2SiO3、Na2SO4溶液,能区分他们的最简单的试剂或方法是( )
| A、焰色反应 | B、盐酸 |
| C、氢氧化钠溶液 | D、水 |
一定量的某有机物完全燃烧后,将燃烧产物通过足量的石灰水,经过滤可得沉淀10g,但称量滤液时,其质量只减少2.9g,则此有机物不可能是( )
| A、乙烷 | B、乙烯 | C、乙醇 | D、乙二醇 |
有一种酸式盐AHB,它的水溶液呈弱碱性.则以下说法:
①相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度;
②H2B不是强酸;
③HB-的电离程度大于HB-的水解程度;
④该盐溶液的电离方程式一般写成:AHB=A++HB-,HB-=H++B2-;
其中错误的是( )
①相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度;
②H2B不是强酸;
③HB-的电离程度大于HB-的水解程度;
④该盐溶液的电离方程式一般写成:AHB=A++HB-,HB-=H++B2-;
其中错误的是( )
| A、①② | B、③④ | C、②③ | D、①④ |
等物质的量的下列有机物完全燃烧,消耗氧气最少的是( )
| A、乙烯 | B、丙烯 | C、乙醇 | D、乙酸 |
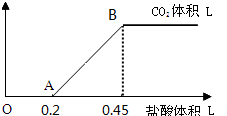
 乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4?xH2O)中x值.通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4?xH2O)中x值.通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O