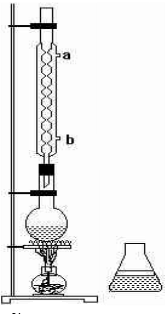
题目内容
现有Na2CO3、NaHCO3、NaOH的固体混合物共27.2g,将固体完全溶于水配成溶液后,向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸溶液的体积与产生的CO2气体体积的关系如图所示: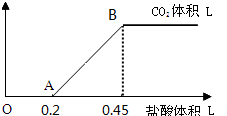
(1)写出OA段所发生反应的离子方程式 ;写出A点时溶质的化学式 ;
(2)B点所产生的CO2的体积是 L(标准状况).
(3)原混合物中NaOH的质量为 g.

(1)写出OA段所发生反应的离子方程式
(2)B点所产生的CO2的体积是
(3)原混合物中NaOH的质量为
考点:有关混合物反应的计算
专题:计算题
分析:(1)假设混合后的溶液中只有Na2CO3,向混合溶液中滴加盐酸,开始发生反应:Na2CO3+HCl═NaHCO3+NaCl,然后发生反应:NaHCO3+HCl═NaCl+H2O+CO2↑,前后2阶段消耗盐酸的体积相等,而实际中生成二氧化碳消耗盐酸较多,说明是Na2CO3和NaHCO3的混合溶液,即OA段发生:Na2CO3+HCl═NaHCO3+NaCl,而AB段发生:NaHCO3+HCl═NaCl+H2O+CO2↑;
(2)由图象可知生成二氧化碳消耗盐酸体积为0.25L,结合方程计算生成二氧化碳的体积;
(3)B点生成二氧化碳最大,此时溶液中溶质为NaCl,由氯离子守恒则n(NaCl)=0.45L×1mol/L=0.45mol,设原混合物中碳酸钠、碳酸氢钠的物质的量为xmol、ymol,根据钠离子守恒表示出NaOH的物质的量,再根据碳元素守恒及混合物总质量列方程计算解答.
(2)由图象可知生成二氧化碳消耗盐酸体积为0.25L,结合方程计算生成二氧化碳的体积;
(3)B点生成二氧化碳最大,此时溶液中溶质为NaCl,由氯离子守恒则n(NaCl)=0.45L×1mol/L=0.45mol,设原混合物中碳酸钠、碳酸氢钠的物质的量为xmol、ymol,根据钠离子守恒表示出NaOH的物质的量,再根据碳元素守恒及混合物总质量列方程计算解答.
解答:
解:(1)假设混合后的溶液中只有Na2CO3,向混合溶液中滴加盐酸,开始发生反应:Na2CO3+HCl═NaHCO3+NaCl,然后发生反应:NaHCO3+HCl═NaCl+H2O+CO2↑,前后2阶段消耗盐酸的体积相等,而实际中生成二氧化碳消耗盐酸较多,说明是Na2CO3和NaHCO3的混合溶液,即OA段发生:Na2CO3+HCl═NaHCO3+NaCl,而AB段发生:NaHCO3+HCl═NaCl+H2O+CO2↑,则:
OA段所发生反应的离子方程式为CO32-+H+=HCO3-,则A点时溶质的化学式:NaHCO3,
故答案为为:CO32-+H+=HCO3-;NaHCO3;
(2)由图象可知生成二氧化碳消耗盐酸体积为0.25L,则消耗HCl的物质的量为0.25L×1mol/L=0.25mol,根据NaHCO3+HCl═NaCl+H2O+CO2↑,可知生成二氧化碳为0.25mol,标况下生成二氧化碳的体积为0.25mol×22.4L/mol=5.6L,故答案为:5.6L;
(3)B点生成二氧化碳最大,此时溶液中溶质为NaCl,由氯离子守恒则n(NaCl)=0.45L×1mol/L=0.45mol,设原混合物中碳酸钠、碳酸氢钠的物质的量为xmol、ymol,根据钠离子守恒,NaOH的物质的量为(0.45-2x-y)mol,根据碳元素守恒及混合物总质量,则:
解得x=0.1,y=0.15
故原混合物中NaOH的质量为27.2g-0.1mol×106g/mol-0.15mol×84g/mol=4g,
故答案为:4.
OA段所发生反应的离子方程式为CO32-+H+=HCO3-,则A点时溶质的化学式:NaHCO3,
故答案为为:CO32-+H+=HCO3-;NaHCO3;
(2)由图象可知生成二氧化碳消耗盐酸体积为0.25L,则消耗HCl的物质的量为0.25L×1mol/L=0.25mol,根据NaHCO3+HCl═NaCl+H2O+CO2↑,可知生成二氧化碳为0.25mol,标况下生成二氧化碳的体积为0.25mol×22.4L/mol=5.6L,故答案为:5.6L;
(3)B点生成二氧化碳最大,此时溶液中溶质为NaCl,由氯离子守恒则n(NaCl)=0.45L×1mol/L=0.45mol,设原混合物中碳酸钠、碳酸氢钠的物质的量为xmol、ymol,根据钠离子守恒,NaOH的物质的量为(0.45-2x-y)mol,根据碳元素守恒及混合物总质量,则:
|
解得x=0.1,y=0.15
故原混合物中NaOH的质量为27.2g-0.1mol×106g/mol-0.15mol×84g/mol=4g,
故答案为:4.
点评:本题考查混合物计算,理解判断各阶段发生的反应是关键,侧重学生分析判断和计算能力的考查,难度中等.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
用NA表示阿伏加德罗常数.下列叙述正确的是( )
| A、1.0 L 0.1 mol/L的NH4Cl溶液中NH4+的数目为0.1NA |
| B、常温下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数为0.1NA |
| C、常温下,0.05 mol CO2和SO2混合气体中所含氧原子数为0.1NA |
| D、高温高压下,1.4 g N2与0.3 g H2反应,生成的NH3分子数为0.1NA |
现有W、X、Y、Z四种物质,它们能发生置换反应:W+X→Y+Z,则Z不可能是( )
| A、Fe3O4 |
| B、NaOH |
| C、Fe(OH)3 |
| D、Si |
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是( )
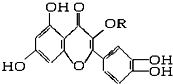

| A、可与溴水反应,且1 mol该物质与足量溴水反应耗6 mol Br2 |
| B、可与NaOH溶液反应,1 mol该物质可与4 mol NaOH反应 |
| C、一定条件下1 mol该物质可与H2加成,耗H2最大量为7 mol |
| D、维生素P遇FeCl3溶液发生显色反应 |
用标准浓度的盐酸滴定未知浓度的NaOH溶液,下列各操作(其他操作正确)中会造成测定结果偏低的是( )
| A、酸式滴定管尖嘴部分有气泡,滴定后消失 |
| B、滴定终点读数时俯视读数 |
| C、用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 |
| D、锥形瓶水洗后未干燥 |
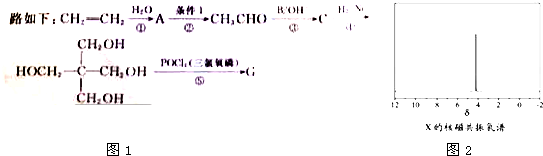
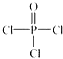 )与
)与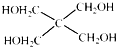 以物质的量之比2:1反应时,生成G,并释放出一种酸性气体,G的核磁共振氢谱如图2所示.
以物质的量之比2:1反应时,生成G,并释放出一种酸性气体,G的核磁共振氢谱如图2所示.