题目内容
用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作导致结果偏低的是( )
| A、酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸 |
| B、锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
| C、滴定前,没有逐出酸式滴定管尖嘴处的气泡,滴定终点时气泡消失 |
| D、滴定前读数正确,达到滴定终点后,俯视读数 |
考点:中和滴定
专题:
分析:根据c(待测)=
分析不当操作对V(标准)的影响,以此判断浓度的误差.
| c(标准)×V(标准) |
| V(待测) |
解答:
解:A.酸式滴定管在滴定前没有润洗,导致其浓度减小,所需体积增大,结果偏高,故A不选;
B.锥形瓶不需要润洗,待测液的物质的量不变,标准液的体积不变,结果不变,故B不选;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,c(待测)偏大,故C不选;
D.读取标准液读数时,滴定前平视,滴定后俯视,导致V(标准)偏小,可知c(待测)偏小,故D选;
故选D.
B.锥形瓶不需要润洗,待测液的物质的量不变,标准液的体积不变,结果不变,故B不选;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,c(待测)偏大,故C不选;
D.读取标准液读数时,滴定前平视,滴定后俯视,导致V(标准)偏小,可知c(待测)偏小,故D选;
故选D.
点评:本题主要考查了中和滴定操作的误差分析,根据c(待测)=)=
分析是解答的关键,题目难度不大.
| c(标准)×V(标准) |
| V(待测) |

练习册系列答案
相关题目
下列各组离子,能在溶液中大量共存的是( )
| A、H+、K+、OH- |
| B、H+、Cl-、CO32- |
| C、Ba+、Na+、SO42- |
| D、Na+、Cu2+、Cl- |
用标准浓度的盐酸滴定未知浓度的NaOH溶液,下列各操作(其他操作正确)中会造成测定结果偏低的是( )
| A、酸式滴定管尖嘴部分有气泡,滴定后消失 |
| B、滴定终点读数时俯视读数 |
| C、用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 |
| D、锥形瓶水洗后未干燥 |
有NaCl、FeCl3、CuCl2、CaCO3,能区分他们的最简单的试剂是( )
| A、盐酸 | B、水 |
| C、氢氧化钠溶液 | D、酒精 |
下列溶液中,微粒的物质的量浓度关系一定正确的是( )
| A、0.1mol?L-1的硫化钾溶液中:c(OH-)>c(HS-)+2c(H2S) |
| B、常温下,pH=7的CH3COOH与CH3COONa的混合液中:c(CHC3OO-)<c(Na+) |
| C、0.1mol?L-1的NH4Cl溶液中:c(NH4+)>c(H+)>c(Cl-)>c(OH-) |
| D、pH=3的一元酸和pH=11的一元强碱等体积混合:c(H+)=c(OH-) |
下列物质中能使干燥的有色布条褪色的是( )
| A、氯水 | B、液氯 | C、氯气 | D、次氯酸 |
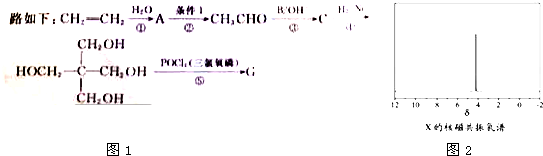
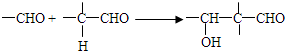
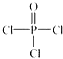 )与
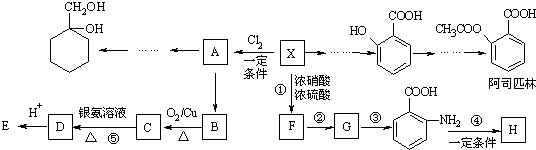
)与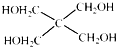 以物质的量之比2:1反应时,生成G,并释放出一种酸性气体,G的核磁共振氢谱如图2所示.
以物质的量之比2:1反应时,生成G,并释放出一种酸性气体,G的核磁共振氢谱如图2所示.
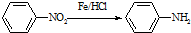 (苯胺,易被氧化)
(苯胺,易被氧化)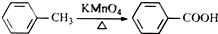
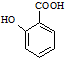 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有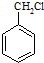 和其他无机物合成
和其他无机物合成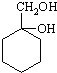 最合理的方案(不超过4步).例:
最合理的方案(不超过4步).例: