题目内容
6.在2L的密闭容器中加入6molSO2和3molO2发生反应:2SO2+O2?2SO3,如果2min时反应达到平衡状态,SO2的浓度下降为1mol•L-1.求:(1)2min内该化学反应速率v(SO2)=1mol/(L.min).
(2)平衡时SO3的物质的量(写出计算过程).
分析 在一定条件下,向体积为2L的容器中加入3mol O2和6mol SO2,O2和SO2浓度分别为1.5mol/L、3mol/L,2min时测得SO2的浓度下降为1mol•L-1,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L):3 1.5 0
变化量(mol/L):2 1 2
2min时(mol/L):1 0.5 2
(1)根据v=$\frac{△c}{△t}$计算v(SO3);
(2)根据n=cV计算平衡时SO3的物质的量.
解答 解:在一定条件下,向体积为2L的容器中加入3mol O2和6mol SO2,O2和SO2浓度分别为1.5mol/L、3mol/L,2min时测得SO2的浓度下降为1mol•L-1,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L):3 1.5 0
变化量(mol/L):2 1 2
2min时(mol/L):1 0.5 2
(1)2min内,平均反应速率v(SO2)=$\frac{2mol/L}{2min}$=1mol/(L.min),
故答案为:1mol/(L.min);
(2)平衡时SO3的物质的量=2mol/L×2L=4mol,
答:平衡时SO3的物质的量为4mol.
点评 本题考查化学平衡计算、反应速率计算,比较基础,有利于基础知识的巩固.

练习册系列答案
相关题目
17.下列各组离子,在指定环境中一定能大量共存的是( )
| A. | 在能使pH试纸变红的溶液中:Fe2+、Na+、Cl-、NO3- | |
| B. | 在含有S2-离子的溶液中:NH4+、K+、Cl-、SO42- | |
| C. | 在由水电离出的c(H+)=10-12mol•L-1的溶液中Na+、Ba2+、Cl- | |
| D. | 在无色溶液中:NH4+、Mg2+、SO42-、SiO32- |
17.某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于如表:
①可以判断该分解反应已经达到平衡的是BC.
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:K=1.6×10-8(mol•L-1)3.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加 (填“增加”,“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.
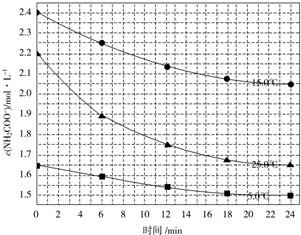
⑤计算25.0℃时,0~6min氨基甲酸铵水解反应的平均速率:0.05mol/(L•min).
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于如表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓 度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:K=1.6×10-8(mol•L-1)3.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加 (填“增加”,“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.

⑤计算25.0℃时,0~6min氨基甲酸铵水解反应的平均速率:0.05mol/(L•min).
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
14.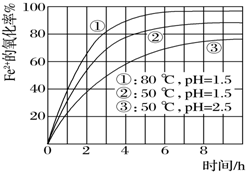 为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法错误的是( )
为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法错误的是( )
 为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法错误的是( )
为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法错误的是( )| A. | pH越小氧化率越小 | |
| B. | 温度越高氧化率越大 | |
| C. | Fe2+的氧化率除受pH、温度影响外,还受其它因素影响,如浓度等 | |
| D. | 实验说明降低pH、升高温度有利于提高Fe2+的氧化率 |
1.下列化学方程式的书写正确的是( )
| A. | 硝酸见光分解:4HNO3$\frac{\underline{\;光照\;}}{\;}$4NO2↑+O2↑+2H2O | |
| B. | 往NaOH溶液中通入过量二氧化硫:2NaOH+SO2═Na2SO3+H2O | |
| C. | SO2气体通入BaCl2溶液中产生白色沉淀:SO2+BaCl2+H2O═BaSO3↓+2HCl | |
| D. | Fe与稀H2SO4反应的化学方程式为:2Fe+3H2SO4═Fe2(SO4)3+3H2↑ |
18.Ni(s)+4CO(g)?Ni(CO)4(g)在一密闭容器中,放入棉粉并充入一定量的CO气体,已知该反应平衡常数与温度的关系下表:下列说法正确的是( )
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述反应是熵增反应 | |
| B. | 在80℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol•L-1,则此时反应逆向进行 | |
| C. | 25℃时,反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数是0.5 | |
| D. | 恒温恒容,向已达平衡的容器中再充入少量Ni(CO)4(g),达到新平衡时,CO的体积百分含量将减小 |
 不饱和酯类化合物在药物、涂料等方面应用广泛.
不饱和酯类化合物在药物、涂料等方面应用广泛. .
.
 (写1种);由Ⅳ生成Ⅱ的反应条件为氢氧化钠的醇溶液、加热.
(写1种);由Ⅳ生成Ⅱ的反应条件为氢氧化钠的醇溶液、加热. 可用于制备涂料.其单体的结构简式为CH2=CHCOOCH2CH3.利用类似反应①的方法,仅以乙烯为有机原料合成该单体,涉及的反应方程式为CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件}{→}$2CH2=CHCOOCH2CH3+2H2O.
可用于制备涂料.其单体的结构简式为CH2=CHCOOCH2CH3.利用类似反应①的方法,仅以乙烯为有机原料合成该单体,涉及的反应方程式为CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件}{→}$2CH2=CHCOOCH2CH3+2H2O.