题目内容
5.以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取钴的氧化物的流程如图1:
(1)步骤Ⅰ中废催化剂用硫酸浸出后,将滤渣1进行再次浸出,其目的是提高钴元素的总浸出率.
(2)步骤Ⅱ需要加热搅拌,相应的离子方程式为6Fe2++6H++ClO3-$\frac{\underline{\;加热\;}}{\;}$ 6Fe3++Cl-+3H2O.
(3)步骤Ⅲ中的反应为2Na++6Fe3++4SO42-+12H2O═Na2Fe6(SO4)4(OH)12+12H+.过滤后母液的pH=2,.0,c(Na+)=a mol•L-1,c(Fe3+)=b mol•L-1,c(SO42-)=d mol•L-1,该反应的平衡常数K=$\frac{(1{0}^{-2})^{12}}{{a}^{2}×{b}^{6}×{d}^{4}}$(用含a、b、d 的代数式表示).
(4)完成步骤Ⅳ中反应的离子方程式:
□5Co2++□CO32-+□H2O═Co5(OH)6(CO3)2↓+□3CO2↑;
(5)已知CoCl2的溶解度曲线如图2所示.步骤Ⅴ向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌,待固体溶解后需趁热过滤.
①边加热边搅拌的原因是加快固体溶解速率;
②趁热过滤的原因是防止因温度降低,CoCl2晶体析出.
分析 钴废催化剂加入稀硫酸,发生Co+H2SO4=CoSO4+H2↑,Fe+H2SO4=FeSO4+H2↑,过滤滤渣是不溶的二氧化硅,而滤液是硫酸钴、硫酸亚铁与过量的硫酸的混合溶液,向滤液中加氯酸钠将亚铁离子氧化成铁离子,然后加入碳酸钠得到黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,继续向滤液中加入碳酸钠,得到碱式碳酸钴[(CoCO3)2•3Co(OH)2],然后用盐酸溶解碱式碳酸钴[(CoCO3)2•3Co(OH)2],再向所到溶液中加入草酸铵,得到溶解度极小的草酸钴,最后燃烧生成氧化钴.
(1)步骤Ⅰ中废催化剂用硫酸浸出后,将滤渣1进行再次浸出,其目的是提高滤液中钴的利用率;
(2)亚铁离子被氯酸根离子氧化成铁离子,根据得失电子守恒分析解答;
(3)依据平衡常数的概念计算,用生成物浓度的幂次方乘积除以反应物浓度的幂次方乘积;
(4)向滤液中加入碳酸钠,得到碱式碳酸钴[(CoCO3)2•3Co(OH)2]和二氧化碳;
(5)①边加热边搅拌,能加快固体溶解在溶剂中的速率;
②CoCl2的溶解度曲线可知,随温度的升高,CoCl2的溶解度增大,所以趁热过滤,防止温度降低氯化钴析出.
解答 解:(1)步骤Ⅰ中废催化剂用硫酸浸出后,将滤渣1进行再次浸出,能够将滤渣中的钴元素的浸出率,所以其目的是提高钴元素的总浸出率,
故答案为:提高钴元素的总浸出率;
(2)亚铁离子被氯酸根离子氧化成铁离子,1molr的亚铁离子失去1mol的电子,而1mol的氯酸根离子得到6mol的电子,根据电子得失守恒,可知离子方程式为:6Fe2++6H++ClO3-═6Fe3++Cl-+3H2O,
故答案为:6Fe2++6H++ClO3-$\frac{\underline{\;加热\;}}{\;}$ 6Fe3++Cl-+3H2O;
(3)除去杂质的化学方程式可表示为:2Na++6Fe3++4SO42-+12H2O═Na2Fe6(SO4)4(OH)12+12H+,过滤后母液的pH=2.0,c(Na+)=a mol•L-1,c(Fe3+)=b mol•L-1,c(SO42-)=d mol•L-1,氢离子浓度为10-2,依据K的表达式写出K=$\frac{{C}^{2}({H}^{+})}{{C}^{2}(N{a}^{+})×{C}^{6}(F{e}^{3+})×{C}^{4}(S{{O}_{4}}^{2-})}$=$\frac{(1{0}^{-2})^{12}}{{a}^{2}×{b}^{6}×{d}^{4}}$,
故答案为:$\frac{(1{0}^{-2})^{12}}{{a}^{2}×{b}^{6}×{d}^{4}}$;
(4)Co2+与CO32-发生双水解,离子方程式为:5Co2++5CO32-+3H2O=Co5(OH)6(CO3)2↓+3CO2↑,
故答案为:5Co2++5CO32-+3H2O=Co5(OH)6(CO3)2↓+3CO2↑;
(5)①边加热边搅拌,能加快固体与溶剂的接触速度,加快固体溶解速率,
故答案为:加快固体溶解速率;
②CoCl2的溶解度曲线可知,随温度的升高,CoCl2的溶解度增大,所以趁热过滤,防止温度降低CoCl2晶体析出,
故答案为:防止因温度降低,CoCl2晶体析出.
点评 本题考查了工艺流程的分析判断,物质分离的方法和试剂选择方法,离子方程式的书写,平衡常数的计算等,需要学生具备知识的基础,题目难度中等.

 阅读快车系列答案
阅读快车系列答案
| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| B. | 图2所知反应xA(g)+yB(g)?zC(g)的△H>0,且a=2 | |
| C. | 若在图1所示的平衡状态下,再向体系中充入He,此时v正>v逆 | |
| D. | 200℃时,向容器中充入1.6molA和0.8molB,达到平衡时,A的转化率大于50% |
| A. | 高铁酸盐(含FeO42-离子)是新型、高效、多功能水处理剂,既能消毒杀菌又能净水 | |
| B. | 用硫酸清洗锅炉中的水垢 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 使用Na2S作沉淀剂,可有效除去废水中Cu2+和Hg2+ |
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 2NO(g)+2CO(g)═N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 | |
| C. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | |
| D. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0 |
| A. | 苯中含苯酚杂质:加入溴水,过滤 | |
| B. | 乙醇中含氯乙烷杂质:加入水,萃取分液 | |
| C. | 乙醛中含乙酸杂质:加入碳酸钠溶液洗涤,分液 | |
| D. | 乙酸丁酯中含乙酸杂质:加入NaOH溶液洗涤,分液 |
| A. | 制取氯乙烷(CH3一CH2Cl)的最好的方法是乙烷与氯气发生取代反应 | |
| B. | 乙烯、苯都能使溴水褪色,两者的褪色原理相同 | |
| C. | 2-丁烯不存在顺反异构体 | |
| D. | 研究有机物一般要经过的基本步骤为:分离、提纯→元素定量分析(确定实验式)→测定相对分子质量(确定分子式)→波谱分析(确定结构式),其中最早提出元素定量分析的是法国化学家李比希 |
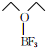 )的熔点为-58℃,沸点为126~129℃,它属于分子晶体.
)的熔点为-58℃,沸点为126~129℃,它属于分子晶体.