题目内容
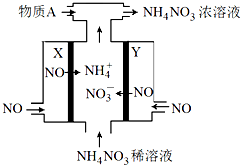 电解NO制备 NH4NO3的工作原理如图所示,X、Y皆Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A.下列说法正确的是
电解NO制备 NH4NO3的工作原理如图所示,X、Y皆Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A.下列说法正确的是( )
| A、物质A为NH3 |
| B、X电极为电解池阳极 |
| C、Y电极上发生了还原反应 |
| D、Y电极反应式为NO-3e-+4OH-═NO3-+2H2O |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:电解NO制备NH4NO3,Y为阳极反应为NO-3e-+2H2O=NO3-+4H+,X为阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O
3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,据此分析.
| ||
解答:
解:电解NO制备NH4NO3,Y为阳极反应为NO-3e-+2H2O=NO3-+4H+,X为阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O
3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3;
A.根据以上分析,则A为NH3,故A正确;
B.根据以上分析,X电极为电解池阴极,故B错误;
C.根据以上分析,Y为阳极发生了氧化反应,故C错误;
D.Y为阳极反应为:NO-3e-+2H2O=NO3-+4H+,故D错误;
故选:A.
| ||
A.根据以上分析,则A为NH3,故A正确;
B.根据以上分析,X电极为电解池阴极,故B错误;
C.根据以上分析,Y为阳极发生了氧化反应,故C错误;
D.Y为阳极反应为:NO-3e-+2H2O=NO3-+4H+,故D错误;
故选:A.
点评:本题考查了电解原理的应用等,题目涉及的知识点较多,侧重于考查学生的综合运用能力,难度中等,注意基础知识的积累掌握.

练习册系列答案
相关题目
窒温下,下列各组离子或分子在指定溶液中能大量共存的是( )
| A、pH=l的溶液中:Na+、Fe2+、N03-、Br2 |
| B、0.1mol.L-1NaOH溶液中:K+、Ba2+、C1-、NO3- |
| C、含有O.1mol.L-1Ca2+的溶液中:Na+、K+、C032-、Cl- |
| D、含有lmol,L-1FeCl3的溶液中:K+、Mg2+、SCN-、N03- |
根据水溶液中存在的平衡关系,判断下列说法正确的是( )
| A、往水中滴加少量稀硫酸,能促进水电离 |
| B、室温下,稀释0.1mol?L-1的醋酸,溶液中所有离子的浓度均降低 |
| C、往AgCl悬浊液中加入0.1mol?L-1Na2S溶液,有黑色沉淀产生 |
| D、浓度均为0.1 mol?L-1的溶液,pH由大到小排列顺序为:NaOH>Na2CO3>NaHSO4>(NH4)2SO4 |
纳米钴(Co)加氢反应的催化剂,500K时催化反应:CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.有关说法正确的是( )
| A、纳米技术的应用,提高了催化剂酌催化性能,但平衡常数不变? |
| B、缩小容器体积,平衡向正反应方向移动CO的浓度减小? |
| C、温度越低,越有利于CO催化加氢 |
| D、从平衡体系中分H2O(g)能加快正反应速率? |
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,22.4L由氢气和氧气组成的混合气体中,所含有的分子总数为NA |
| B、标准状况下,22.4L氦气中含原子数为2NA |
| C、1mol氯气与足量NaOH溶液反应,转移的电子数为2NA |
| D、1molCH3+(碳正离子)中含有电子数为10 NA |
 将H2S通人FeCl3溶液中,过滤后将反应液加人电解槽中电解(如图所示)电解后的溶液还可以循环利用.该方法可用于处理石油炼制过程中产生的H2S废气.下列有关说法正确的是( )
将H2S通人FeCl3溶液中,过滤后将反应液加人电解槽中电解(如图所示)电解后的溶液还可以循环利用.该方法可用于处理石油炼制过程中产生的H2S废气.下列有关说法正确的是( )| A、过滤得到的沉淀可能是FeS和S |
| B、若有0.20mol的电子转移,一定能得到2.24L的氢气 |
| C、可以用Fe与外接电源的a极相连 |
| D、与a极相连的电极反应为Fe2+-e-=Fe3+ |
 如图是设计的一种航天器能量储存系统原理示意图.它是利用太阳能和物质间的物质变化和能量转换实现循环使用.下列说法正确的是( )
如图是设计的一种航天器能量储存系统原理示意图.它是利用太阳能和物质间的物质变化和能量转换实现循环使用.下列说法正确的是( )| A、二氧化硅是太阳能电池的光电转换材料 |
| B、装置X中阳极反应式:Br2+2e-2Br- |
| C、装置Y中正极反应式为:Br2+2e-2Br- |
| D、有了这套装置后就不用考虑节能减排了 |
下列物质中,含有共价键的单质是( )
| A、H2S |
| B、Ar |
| C、NaOH |
| D、N2 |
如表为元素周期表短周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )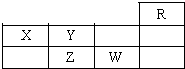

| A、常压下五种元素的单质中W单质的沸点最高 |
| B、Z的氢化物比Y的氢化物稳定 |
| C、W元素最高价氧化物的水化物酸性比Z元素的强 |
| D、Z、W的阴离子电子层结构与R原子的相同 |