题目内容
纳米钴(Co)加氢反应的催化剂,500K时催化反应:CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.有关说法正确的是( )
| A、纳米技术的应用,提高了催化剂酌催化性能,但平衡常数不变? |
| B、缩小容器体积,平衡向正反应方向移动CO的浓度减小? |
| C、温度越低,越有利于CO催化加氢 |
| D、从平衡体系中分H2O(g)能加快正反应速率? |
考点:化学平衡的影响因素,化学平衡建立的过程
专题:化学平衡专题
分析:A、平衡常数只与温度有关;
B、缩小容器体积,平衡正向移动,反应物和生成物浓度都比原平衡大;
C、催化剂的活性受温度影响;
D、分离出生成物,平衡正向移动,正逆反应速率都比原平衡低.
B、缩小容器体积,平衡正向移动,反应物和生成物浓度都比原平衡大;
C、催化剂的活性受温度影响;
D、分离出生成物,平衡正向移动,正逆反应速率都比原平衡低.
解答:
解:A、平衡常数只与温度有关,温度不变,平衡常数不变,故A正确;
B、缩小容器体积,平衡正向移动,反应物和生成物浓度都比原平衡大,故B错误;
C、催化剂的活性受温度影响,降温催化剂活性下降,不利于CO的催化加氢,故C错误;
D、降低生成物浓度,达到新的平衡,正逆反应速率比原平衡慢,故D错误;
故选:A.
B、缩小容器体积,平衡正向移动,反应物和生成物浓度都比原平衡大,故B错误;
C、催化剂的活性受温度影响,降温催化剂活性下降,不利于CO的催化加氢,故C错误;
D、降低生成物浓度,达到新的平衡,正逆反应速率比原平衡慢,故D错误;
故选:A.
点评:本题考查了影响化学反应速率和平衡移动的因素,题目难度中等.

练习册系列答案
相关题目
下列有关推断正确的是( )
| A、SO3 是酸性氧化物,能与NaOH溶液反应 |
| B、Na2O、Na2O2组成元素相同,与CO2反应产物也相同 |
| C、酸酐一定是氧化物,金属氧化物一定是碱性氧化物 |
| D、新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
下列关于pH=3的盐酸和醋酸溶液的说法正确的是( )
| A、两种溶液中由水电离出来的c(H+)不相同 |
| B、中和相同体积的两种酸溶液所需NaOH的物质的量分别为a和b,则a<b |
| C、加入足量的铁粉,放出H2的体积相同 |
| D、分别用蒸馏水稀释m倍和n倍,两溶液pH仍相同,则m=n |
在2FeCl2+Cl2=2FeCl3的反应中,还原剂是( )
| A、Cl2 |
| B、FeCl2 |
| C、Fe |
| D、FeCl3 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、24gO2分子和24gO3分子所含的氧原子数目相等 |
| B、标准状况下,22.4L水中含有的水分子数为NA |
| C、标准状况下,22.4L氯化氢所含的原子数为NA |
| D、1molN2所含有的原子数为NA |
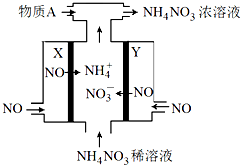 电解NO制备 NH4NO3的工作原理如图所示,X、Y皆Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A.下列说法正确的是
电解NO制备 NH4NO3的工作原理如图所示,X、Y皆Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A.下列说法正确的是( )
| A、物质A为NH3 |
| B、X电极为电解池阳极 |
| C、Y电极上发生了还原反应 |
| D、Y电极反应式为NO-3e-+4OH-═NO3-+2H2O |
化学反应伴随能量变化,下列说法中错误的是( )
| A、TNT(炸药)爆炸时部分化学能转化为热能 |
| B、电解饱和食盐水时部分化学能转化为电能 |
| C、镁条燃烧时部分化学能转化为光能 |
| D、植物光合作用时部分光能转化为化学能 |