题目内容
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,22.4L由氢气和氧气组成的混合气体中,所含有的分子总数为NA |
| B、标准状况下,22.4L氦气中含原子数为2NA |
| C、1mol氯气与足量NaOH溶液反应,转移的电子数为2NA |
| D、1molCH3+(碳正离子)中含有电子数为10 NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、标准状况下,22.4L混合气体的物质的量为1mol;
B、氦气为单原子分子;
C、氯气与氢氧化钠的反应为歧化反应;
D、1molCH3+含8mol电子.
B、氦气为单原子分子;
C、氯气与氢氧化钠的反应为歧化反应;
D、1molCH3+含8mol电子.
解答:
解:A、标况下,22.4L由氢气和氧气组成的混合气体的物质的量为1mol,所含有的分子总数为NA,故A正确;
B、标况下,22.4L氦气的物质的量为1mol,但氦气为单原子分子,故1mol氦气中含1mol氦原子,故B错误;
C、氯气与氢氧化钠的反应为歧化反应,1mol氯气转移1mol电子,故C错误;
D、1molCH3+含8mol电子,电子数为8NA个,故D错误.
故选A.
B、标况下,22.4L氦气的物质的量为1mol,但氦气为单原子分子,故1mol氦气中含1mol氦原子,故B错误;
C、氯气与氢氧化钠的反应为歧化反应,1mol氯气转移1mol电子,故C错误;
D、1molCH3+含8mol电子,电子数为8NA个,故D错误.
故选A.
点评:本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某同学弄清氨的喷泉实验原理后有了一个创新设计:如果改换一下烧瓶内的气体和胶头滴管与烧杯中的液体,也能做成喷泉实验.那么下列各组中的气体和液体不符合该学生设计的一组是( )
| A、SO2和NaOH溶液 |
| B、CO2和NaOH溶液 |
| C、Cl2和饱和食盐水 |
| D、Cl2和NaOH溶液 |
下列气体不会造成空气污染的是( )
| A、NO |
| B、NO2 |
| C、N2 |
| D、SO2 |
在2FeCl2+Cl2=2FeCl3的反应中,还原剂是( )
| A、Cl2 |
| B、FeCl2 |
| C、Fe |
| D、FeCl3 |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、1 mol N2所含有的原子数为NA |
| B、标准状况下,22.4 L SO3中含有的分子数为NA |
| C、标准状况下,22.4 L氨气所含的原子数为NA |
| D、16 g O2和O3的混合气体所含的氧原子数为NA |
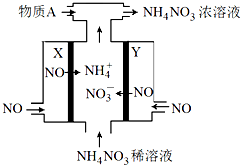 电解NO制备 NH4NO3的工作原理如图所示,X、Y皆Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A.下列说法正确的是
电解NO制备 NH4NO3的工作原理如图所示,X、Y皆Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A.下列说法正确的是( )
| A、物质A为NH3 |
| B、X电极为电解池阳极 |
| C、Y电极上发生了还原反应 |
| D、Y电极反应式为NO-3e-+4OH-═NO3-+2H2O |
设nA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,22.4L氯气与过量的铁完全反应,转移电子数为2nA |
| B、42gC3H6中含有的共用电子对数目为8nA |
| C、加热下,1molH2和1molI2混合反应生成的气体分子数为2nA |
| D、0.01mol?L-1的KAl(SO4)2溶液中含有0.02nA个SO42- |
