题目内容
19.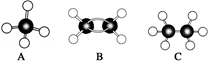 现有A、B、C三种烃,其球棍模型图:
现有A、B、C三种烃,其球棍模型图:(1)等质量的以上物质完全燃烧时耗去O2的量最多的是A(填对应字母,下同);
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是C;
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是B.
(4)在120℃、1.01×105 Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是A、B.
分析 由球棍模型可知A为CH4,B为C2H4,C为C2H6,根据各有机物的分子组成以及与氧气反应的化学方程式进行计算和判断.
解答 解:由球棍模型可知A为CH4,B为C2H4,C为C2H6.
(1)等质量的烃CxHy完全燃烧时,氢元素的质量分数越大,耗氧量越大,CH4、C2H4、C2H6中的$\frac{y}{x}$依次为4、2、3,故CH4耗O2最多,
故答案为:A;
(2)同状况、同体积,物质的量相同,等物质的量的烃CxHy完全燃烧时,(x+$\frac{y}{4}$)的值越大,耗氧量越大,CH4、C2H4、C2H6的x+$\frac{y}{4}$依次为2、3、3.5,故C2H6耗O2最多,故答案为:C;
(3)设有机物都为1g,n(CO2)=n(C)则生成的CO2分别为$\frac{1}{16}$×1、$\frac{1}{28}$×2、$\frac{1}{30}$×2,$\frac{1}{28}$×2最大,故C2H4生成的CO2最多,
故答案为:B;
(4)温度≥100℃条件下,当烃分子中含有4个氢原子时,该烃完全燃烧前后气体体积不变,y=4的为CH4、C2H4,故为CH4、C2H4,
故答案为:A、B.
点评 本题考查有机物的结构与性质,为高频考点,把握常见有机物的结构、球棍模型等推断有机物为解答的关键,侧重分析与计算能力的考查,注意有机物燃烧规律的应用,题目难度不大,

练习册系列答案
相关题目
10.下列物质不是常见的氧化剂的是( )
| A. | O2 | B. | HNO3 | C. | KMnO4 | D. | CO |
14.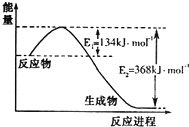 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
(1)如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)在一定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:
完成下列问题:
①比较K1、K2的大小:K1> K2(填“>”、“=”或“<”).
②判断该反应达到化学平衡状态的依据是AC (填序号).
A.2vH2(正)=3vNH2(逆) B.3vH2(正)=2vH2(正)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式N2H62++H2O═[N2H5•H2O]++H+.
②盐酸肼水溶液中离子浓度的排列顺序正确的是AC (填序号).
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5•H2O]+)>c(H+)>c(OH-)
C.2c(N2H62+)+c([N2H5•H2O]+)+c(H+)═c(Cl-)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:(1)如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)在一定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol•L-1) | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1> K2(填“>”、“=”或“<”).
②判断该反应达到化学平衡状态的依据是AC (填序号).
A.2vH2(正)=3vNH2(逆) B.3vH2(正)=2vH2(正)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式N2H62++H2O═[N2H5•H2O]++H+.
②盐酸肼水溶液中离子浓度的排列顺序正确的是AC (填序号).
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5•H2O]+)>c(H+)>c(OH-)
C.2c(N2H62+)+c([N2H5•H2O]+)+c(H+)═c(Cl-)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
11.如图操作或装置能达到实验目的是( )
| A. |  除去氯气中的HCl气体 | |
| B. | 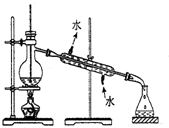 分离Na2CO3溶液和CH3COOC2H5的混合物 | |
| C. | 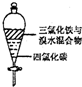 可以萃取,充分振荡后静置,下层溶液为橙红色,上层为无色 | |
| D. | 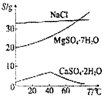 溶解度变化可知,在较低温度下容易分离MgSO4•7H2O和CaSO4•2H2O |
8.下列实验目的对应的实验操作和实验原理均正确的是( )
| 实验目的 | 实验操作 | 实验原理 | |
| A | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡 | 3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+ |
| B | 配制FeCl3溶液 | 将FeCl3固体溶解于适量硫酸溶液 | H+抑制FeCl3水解 |
| C | 检验溶液中是否含有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | NH3溶于水后溶质的主要存在形式是NH4+、OH- |
| D | 提纯混有少量硝酸钾的氯化钠 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升高显著增大 |
| A. | A | B. | B | C. | C | D. | D |
9.下列反应中可加入还原剂进行的是( )
| A. | Zn→Zn2+ | B. | H2→H2O | C. | Cl2→Cl- | D. | CuO→CuCl2 |
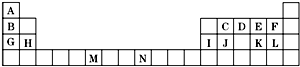 如表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
如表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.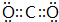 ,BA2分子中化学键属于共价键.
,BA2分子中化学键属于共价键. .
.