题目内容
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A、0.2mol/LCH3COONa与0.1mol/LHCl溶液等体积混合(pH<7):c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)>c(OH-) |
| B、0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| C、0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
| D、0.1mol/LNa2CO3与0.2mol/L NaHCO3溶液等体积混合:3c(Na+)=4[c(CO32-)+c(HCO3-)+c(H2CO3)] |
考点:离子浓度大小的比较
专题:
分析:A.溶液中的溶质为等物质的量浓度的CH3COONa、CH3COOH和NaCl,CH3COO-水解程度小于CH3COOH电离程度,溶液呈酸性;
B.混合溶液中NH3?H2O电离程度小于NH4+水解程度,溶液呈碱性,但NH3?H2O电离和NH4+水解程度都较小;
C.二者恰好反应生成等物质的量浓度的NaHC2O4和NaCl,溶液中存在电荷守恒,根据电荷守恒判断;
D.任何电解质溶液中都存在物料守恒,根据物料守恒判断.
B.混合溶液中NH3?H2O电离程度小于NH4+水解程度,溶液呈碱性,但NH3?H2O电离和NH4+水解程度都较小;
C.二者恰好反应生成等物质的量浓度的NaHC2O4和NaCl,溶液中存在电荷守恒,根据电荷守恒判断;
D.任何电解质溶液中都存在物料守恒,根据物料守恒判断.
解答:
解:A.溶液中的溶质为等物质的量浓度的CH3COONa、CH3COOH和NaCl,CH3COO-水解程度小于CH3COOH电离程度,溶液呈酸性,根据物料守恒得,其浓度大小顺序是c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)>c(OH-),故A正确;
B.混合溶液中NH3?H2O电离程度小于NH4+水解程度,溶液呈碱性,但NH3?H2O电离和NH4+水解程度都较小,所以c(NH3?H2O)<c(NH4+),故B错误;
C.二者恰好反应生成等物质的量浓度的NaHC2O4和NaCl,溶液中存在电荷守恒,根据电荷守恒得2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+),故C错误;
D.任何电解质溶液中都存在物料守恒,根据物料守恒得3c(Na+)=4[c(CO32-)+c(HCO3-)+c(H2CO3)],故D正确;
故选AD.
B.混合溶液中NH3?H2O电离程度小于NH4+水解程度,溶液呈碱性,但NH3?H2O电离和NH4+水解程度都较小,所以c(NH3?H2O)<c(NH4+),故B错误;
C.二者恰好反应生成等物质的量浓度的NaHC2O4和NaCl,溶液中存在电荷守恒,根据电荷守恒得2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+),故C错误;
D.任何电解质溶液中都存在物料守恒,根据物料守恒得3c(Na+)=4[c(CO32-)+c(HCO3-)+c(H2CO3)],故D正确;
故选AD.
点评:本题考查离子浓度大小比较,明确溶液中的溶质及其溶液酸碱性是解本题关键,再结合守恒思想分析解答,易错选项是C,注意溶液中还存在阴离子氯离子,为易错点.

练习册系列答案
相关题目
最外层为N层的基态原子中,未成对的电子数目最多为( )个.
| A、4 | B、5 | C、6 | D、7 |
某有机物其结构简式如图关于该有机物,下列叙述不正确的是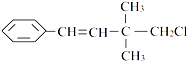 ( )
( )
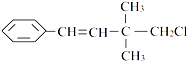 ( )
( )| A、一定条件下,能发生加聚反应 |
| B、能使溴水褪色 |
| C、一定条件下,能发生取代反应 |
| D、能与NaOH的醇溶液共热发生消去反应 |
经测定某种溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法错误的是( )
| A、若满足:c(Cl-)=c(NH4+)>c(OH-)=c(H+),则溶质一定是NH4Cl |
| B、若满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶质一定是NH4Cl和NH3-?H2O |
| C、溶液中四种离子之间可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D、若满足:c(NH4+)=c(Cl-),则溶液一定呈中性 |
钙是人体必需的常量元素,成年人每天需要800毫克的钙,下列补钙的途径正确的是( )
| A、经常饮用咖啡、碳酸饮料 |
| B、经常饮用钙离子含量高的硬水 |
| C、经常饮用牛奶、豆奶 |
| D、大量补充维生素C |
下列关于淀粉、脂肪、蛋白质的说法中错误的是( )
| A、它们都是生活中常见的高分子化合物 |
| B、它们都是有机化合物 |
| C、它们在一定条件下都能发生水解反应 |
| D、它们都是生物体进行生命活动的能源 |
已知反应:2M(g)+N(g)+P(g)
2Q(g)+3R(g)△H>0,在恒容的密闭容器中,下列有关说法正确的是( )
| 催化剂 |
| 180℃ |
| A、平衡时,其他条件不变,增加M的浓度,N的转化率减小 |
| B、平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| C、单位时间内消耗N和Q的物质的量比为1:1时,反应达到平衡 |
| D、其他条件不变,使用高效催化剂,N和P的转化率增大 |
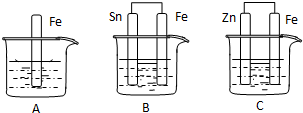 如图所示,烧杯中都盛有稀硫酸.
如图所示,烧杯中都盛有稀硫酸.