题目内容
某化学兴趣小组设计如下实验,研究生铁(含碳)与浓硫酸(90%)的反应情况及产物的性质.
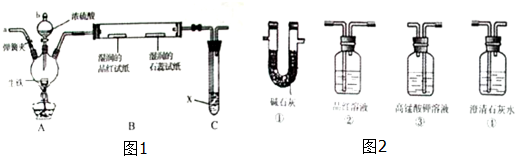
(1)按如图1所示装置(夹持或支持装置未画出)进行实验,请回答下列问题:
①仪器b的名称是 ,实验过程中,装置B中观察到的现象是 .
②装置C中盛放的x为硝酸钡溶液,气体通入一段时间后有白色沉淀生成,该沉淀是 ,若盛放的x为溴水,发生反应的离子方程式 .
③停止加热后,用洗耳球多次从a玻璃管口向装置内鼓入空气,目的是
(2)为了验证装置中产生的气体含有CO2,请从装置或仪器(图2)中选出必要的进行试验,按气流按气流从左到右顺序排序(填序号) ,产生CO2气体的化学方程式为 .
(3)有同学认为实验后期气体中可能还含有H2,理由是 ;通过实验验证确有该气体存在,则反应后的溶液中,除氢离子外,还大量存在的阳离子是 .

(1)按如图1所示装置(夹持或支持装置未画出)进行实验,请回答下列问题:
①仪器b的名称是
②装置C中盛放的x为硝酸钡溶液,气体通入一段时间后有白色沉淀生成,该沉淀是
③停止加热后,用洗耳球多次从a玻璃管口向装置内鼓入空气,目的是
(2)为了验证装置中产生的气体含有CO2,请从装置或仪器(图2)中选出必要的进行试验,按气流按气流从左到右顺序排序(填序号)
(3)有同学认为实验后期气体中可能还含有H2,理由是
考点:浓硫酸的性质实验,铁及其化合物的性质实验
专题:实验题
分析:(1)①由装置图可知,仪器b为分液漏斗,生铁(含碳)与浓硫酸反应生成二氧化硫,可使湿润的品红试纸褪色,湿润的石蕊试纸变红;
②硝酸具有氢氧化性,把二氧化硫通入硝酸钡溶液,会生成硫酸钡沉淀,二氧化硫和溴水反应生成硫酸和氢溴酸;
③二氧化硫与C中物质发生化学反应,降低了装置内压强,容易发生倒吸,且二氧化硫污染大气;
(2)先用酸性高锰酸钾溶液吸收二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,最后通入澄清石灰水检验二氧化碳,C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;
(3)随着反应的进行浓硫酸变为稀硫酸,Fe和稀硫酸反应生成氢气,铁离子的氧化性大于氢离子,因此溶液中含有大量的Fe2+.
②硝酸具有氢氧化性,把二氧化硫通入硝酸钡溶液,会生成硫酸钡沉淀,二氧化硫和溴水反应生成硫酸和氢溴酸;
③二氧化硫与C中物质发生化学反应,降低了装置内压强,容易发生倒吸,且二氧化硫污染大气;
(2)先用酸性高锰酸钾溶液吸收二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,最后通入澄清石灰水检验二氧化碳,C+2H2SO4(浓)
| ||
(3)随着反应的进行浓硫酸变为稀硫酸,Fe和稀硫酸反应生成氢气,铁离子的氧化性大于氢离子,因此溶液中含有大量的Fe2+.
解答:
解:(1)①由装置图可知,仪器b为分液漏斗,生铁(含碳)与浓硫酸反应生成二氧化硫,可使湿润的品红试纸褪色,湿润的石蕊试纸变红,
故答案为:分液漏斗;品红试纸褪色,石蕊试纸变红;
②硝酸具有氢氧化性,把二氧化硫通入硝酸钡溶液,会生成硫酸钡沉淀,二氧化硫和溴水反应生成硫酸和氢溴酸,化学方程式为SO2+2H2O+Br2=4H++SO42-+2Br-,
故答案为:BaSO4;SO2+2H2O+Br2=4H++SO42-+2Br-;
③二氧化硫与C中物质发生化学反应,降低了装置内压强,容易发生倒吸,从a玻璃管口向装置内鼓入空气,可以增大装置内压强,防止倒吸,排净装置中的二氧化硫,防止污染环境,
故答案为:防止装置C中的溶液倒吸,排净装置中的二氧化硫,防止污染环境;
(2)二氧化碳和二氧化硫都能使澄清石灰水变浑浊,因此应先用酸性高锰酸钾溶液吸收二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,最后通入澄清石灰水检验二氧化碳,产生二氧化碳的化学方程式为C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,
故答案为:③②④;C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;
(3)随着反应的进行浓硫酸变为稀硫酸,Fe和稀硫酸反应生成氢气,铁与浓硫酸反应生成铁离子,铁离子的氧化性大于氢离子,铁离子与铁反应生成Fe2+,因此溶液中含有大量的Fe2+,
故答案为:随着反应的进行浓硫酸变为稀硫酸,Fe和稀硫酸反应生成氢气;Fe2+.
故答案为:分液漏斗;品红试纸褪色,石蕊试纸变红;
②硝酸具有氢氧化性,把二氧化硫通入硝酸钡溶液,会生成硫酸钡沉淀,二氧化硫和溴水反应生成硫酸和氢溴酸,化学方程式为SO2+2H2O+Br2=4H++SO42-+2Br-,
故答案为:BaSO4;SO2+2H2O+Br2=4H++SO42-+2Br-;
③二氧化硫与C中物质发生化学反应,降低了装置内压强,容易发生倒吸,从a玻璃管口向装置内鼓入空气,可以增大装置内压强,防止倒吸,排净装置中的二氧化硫,防止污染环境,
故答案为:防止装置C中的溶液倒吸,排净装置中的二氧化硫,防止污染环境;
(2)二氧化碳和二氧化硫都能使澄清石灰水变浑浊,因此应先用酸性高锰酸钾溶液吸收二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,最后通入澄清石灰水检验二氧化碳,产生二氧化碳的化学方程式为C+2H2SO4(浓)
| ||
故答案为:③②④;C+2H2SO4(浓)
| ||
(3)随着反应的进行浓硫酸变为稀硫酸,Fe和稀硫酸反应生成氢气,铁与浓硫酸反应生成铁离子,铁离子的氧化性大于氢离子,铁离子与铁反应生成Fe2+,因此溶液中含有大量的Fe2+,
故答案为:随着反应的进行浓硫酸变为稀硫酸,Fe和稀硫酸反应生成氢气;Fe2+.
点评:本题考查了浓硫酸性质的分析判断,产物性质的实验验证实验方法和反应现象应用,主要是二氧化硫性质的分析应用,题目难度中等.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
在298K、100kPa时,已知:2H2O(g)=O2(g)+2H2(g)△H1
Cl2(g)+H2(g)=2HCl(g )△H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是( )
Cl2(g)+H2(g)=2HCl(g )△H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是( )
| A、△H3=△H1+2△H2 |
| B、△H3=△H1+△H2 |
| C、△H3=△H1-2△H2 |
| D、△H3=△H1-△H2 |
用CH4催化还原NOx可以消除氮氧化物的污染.例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1,CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1.若在标准状况下4.48L CH4恰好能将一定量NO2还原成N2和H2O(g),则整个过程中放出的热量为( )
| A、114.8 kJ |
| B、232 kJ |
| C、368.8 kJ |
| D、173.4 kJ |
如图所示装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体,该装置可用于( )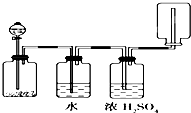

| A、KMnO4分解生成氧气 |
| B、二氧化锰和盐酸生产氯气 |
| C、碳酸钙和盐酸生成二氧化碳 |
| D、锌和盐酸生成氢气 |
把足量熟石灰放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
| A、给溶液加热,溶液的pH升高 |
| B、恒温下向溶液中加入CaO,溶液n(Ca2+)减少 |
| C、向溶液中加入Na2CO3溶液,则其中的Ca(OH)2的固体增多 |
| D、向溶液中加入少量的NaOH固体,则其中的Ca(OH)2的固体增多 |

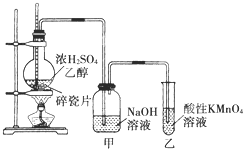 如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置.
如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置.