题目内容
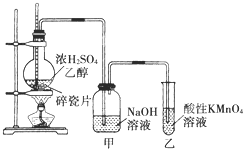 如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置.
如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置.请回答:
(1)实验步骤:①
②在各装置中注入相应的试剂(如图所示);
③点燃酒精灯加热;实验时,烧瓶中液体混合物逐渐变黑.
(2)写出实验室制取乙烯的化学方程式:
(3)写出乙醇催化氧化的化学方程式:
(4)能够证明生成乙烯的现象是
考点:乙醇的消去反应,乙烯的化学性质
专题:实验题
分析:(1)依据实验目的:制取乙烯并验证乙烯具有还原性,首先应组装仪器,然后检验仪器的气密性,装药品,制备乙烯,性质验证;
(2)乙醇在浓硫酸做催化剂、脱水剂条件下,反应生成乙烯;
(3)乙醇催化氧化生成乙醛;
(4)乙烯具有还原性,能够被酸性的高锰酸钾氧化;乙醇、二氧化硫也具有还原性,能被酸性高锰酸钾氧化.
(2)乙醇在浓硫酸做催化剂、脱水剂条件下,反应生成乙烯;
(3)乙醇催化氧化生成乙醛;
(4)乙烯具有还原性,能够被酸性的高锰酸钾氧化;乙醇、二氧化硫也具有还原性,能被酸性高锰酸钾氧化.
解答:
解:(1)解要制取乙烯并验证乙烯具有还原性,首先应组装仪器,检验装置的气密性;
故答案为:组装仪器,检验装置的气密性;
(2)乙醇在浓硫酸做催化剂、脱水剂条件下,反应生成乙烯,化学方程式为:CH3CH2OH
CH2=CH2↑+H2O;
故答案为:CH3CH2OH
CH2=CH2↑+H2O;
(3)乙醇催化氧化生成乙醛:2CH3CH2OH+O2
2CH3CHO+2H2O;
故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O;
(4)乙烯具有还原性,能够被酸性的高锰酸钾氧化,所以会看到高锰酸钾溶液褪色;乙醇也具有还原性,能被酸性高锰酸钾氧化,使高锰酸钾褪色,装置甲的作用吸收挥发出来的乙醇和生成的杂质二氧化硫,防止对乙烯性质检验的干扰,如果没有甲装置,不能确定是否有乙烯生成;
故答案为:高锰酸钾溶液褪色;乙醇、二氧化硫也能够使高锰酸钾褪色,装置甲的作用除去挥发出来的乙醇和生成的杂质二氧化硫,如果没有甲,不能检验生成物为乙烯.
故答案为:组装仪器,检验装置的气密性;
(2)乙醇在浓硫酸做催化剂、脱水剂条件下,反应生成乙烯,化学方程式为:CH3CH2OH
| 浓硫酸 |
| 170℃ |
故答案为:CH3CH2OH
| 浓硫酸 |
| 170℃ |
(3)乙醇催化氧化生成乙醛:2CH3CH2OH+O2
| 铜或银 |
| △ |
故答案为:2CH3CH2OH+O2
| 铜或银 |
| △ |
(4)乙烯具有还原性,能够被酸性的高锰酸钾氧化,所以会看到高锰酸钾溶液褪色;乙醇也具有还原性,能被酸性高锰酸钾氧化,使高锰酸钾褪色,装置甲的作用吸收挥发出来的乙醇和生成的杂质二氧化硫,防止对乙烯性质检验的干扰,如果没有甲装置,不能确定是否有乙烯生成;
故答案为:高锰酸钾溶液褪色;乙醇、二氧化硫也能够使高锰酸钾褪色,装置甲的作用除去挥发出来的乙醇和生成的杂质二氧化硫,如果没有甲,不能检验生成物为乙烯.
点评:本题为实验题,侧重考查乙烯的制备和性质的检验,有机化学方程式的书写,明确乙醇的性质、乙烯制备实验的原理是解题关键,题目难度不大,注意对实验的基本操作的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知:C(s)+
O2(g)═CO(g)△H=-110.5kJ?mol-1①
C(s)+O2(g)═CO2(g)△H=-393.51kJ?mol-1②
计算反应C(s)+CO2(g)═2CO(g)的反应热△H的值为( )
| 1 |
| 2 |
C(s)+O2(g)═CO2(g)△H=-393.51kJ?mol-1②
计算反应C(s)+CO2(g)═2CO(g)的反应热△H的值为( )
| A、-283.01kJ?mol-1 |
| B、+172.51kJ?mol-1 |
| C、+283.1kJ?mol-1 |
| D、+504.00kJ?mol-1 |
氢气和氯气的混合气体遇强光照射时,会发生爆炸现象,并在瓶口形成( )
| A、白烟 | B、白雾 |
| C、白色烟雾 | D、棕色烟 |
 ,不符合
,不符合