题目内容
13.在第二周期中,第一电离能最小的元素符号是Li.第一电离能最大的元素符号是Ne.分析 同周期随原子序数增大,元素第一电离能呈增大趋势,当ⅡA族的s能级为全满稳定状态,ⅤA族的p能级为半满稳定状态,第一电离能高于同周期相邻元素的,而稀有气体外围电子排布为2s22p6,达全满的稳定结构,所以第一电离最大,由此分析解答.
解答 解:同周期随原子序数增大,元素第一电离能呈增大趋势,当ⅡA族的s能级为全满稳定状态,ⅤA族的p能级为半满稳定状态,第一电离能高于同周期相邻元素的,而稀有气体外围电子排布为2s22p6,达全满的稳定结构,所以第一电离最大,即第二周期,第一电离能最小的元素符号是Li;最大的是Ne,
故答案为:Li;Ne.
点评 本题考查元素的第一电离能,为高频考点,把握同周期元素的性质变化规律,半满、全满等为解答的关键,侧重分析与应用能力的考查,注意半满为稳定结构难失去电子,题目难度不大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
4.下列气体有颜色的是( )
| A. | C2H4 | B. | Cl2 | C. | NH3 | D. | NO |
1.含氯消毒液(主要成分NaClO)与含氯洁厕灵(主要成分HCl)混用可能会造成中毒,其原因是:NaClO+2HCl═Cl2↑+NaCl+H2O.下列说法中正确的是( )
| A. | NaCl是还原产物 | |
| B. | NaClO只含有离子键 | |
| C. | 当释放(标况下)2.24L Cl2时,一定有6.02×1022个氯分子扩散到室内 | |
| D. | 使用消毒液时滴加食醋可加快作用发挥,其原因用离子方程式表示为 ClO-+CH3COOH═HClO+CH3COO- |
8.100mL 0.1mol/L 硫酸铁溶液和 100mL 0.2mol/L硫酸钠溶液中,SO42-的物质的量浓度之比是( )
| A. | 1:2 | B. | 3:1 | C. | 3:2 | D. | 4:3 |
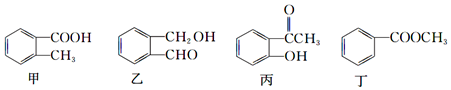
18.甲、乙、丙、丁四种有机物的结构简式及常见的反应类型如下:
①加成反应
②取代反应
③氧化反应
④消去反应
⑤银镜反应
⑥与新制的Cu(OH)2反应
⑦酯化反应
下列对它们能发生的反应类型的判断中正确的是( )

①加成反应
②取代反应
③氧化反应
④消去反应
⑤银镜反应
⑥与新制的Cu(OH)2反应
⑦酯化反应
下列对它们能发生的反应类型的判断中正确的是( )
| A. | 甲:①②③④⑥⑦ | B. | 乙:①②③⑤⑥⑦ | C. | 丙:①②③④⑤⑥⑦ | D. | 丁:②③④⑤⑥⑦ |
5.化合物X是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( )
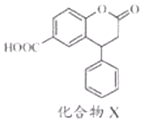

| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 1mol化合物X最多可与8molH2发生加成反应 | |
| C. | 在酸性条件下水解,水解产物只有一种 | |
| D. | 1mol化合物X最多能与2molNaOH反应 |
2.下列过程有化学键被破坏同时又有化学键形成的是( )
| A. | 碘升华 | B. | 氯气溶于水 | C. | 氯化钠晶体熔融 | D. | NH4Cl |
 一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.
一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.


