题目内容
(注意单位的书写!)
(1)写出硫酸钾的电离方程式: ,在0.5L,0.5mol/L的硫酸钾溶液中,钾离子的物质的量为 ;
(2)0.5molSO2的质量是 g,在标准状况下的体积为 L;
(3)标准状况下,将11.2L的HCl溶解于水配成500mL的溶液,则溶液的物质的量浓度为
(4)配制300mL 0.5mol/L氯化钠溶液,需要1.5mol/L的氯化钠溶液的体积是 mL.
(1)写出硫酸钾的电离方程式:
(2)0.5molSO2的质量是
(3)标准状况下,将11.2L的HCl溶解于水配成500mL的溶液,则溶液的物质的量浓度为
(4)配制300mL 0.5mol/L氯化钠溶液,需要1.5mol/L的氯化钠溶液的体积是
考点:物质的量的相关计算,电离方程式的书写
专题:计算题
分析:(1)硫酸钾属于盐,电离产生钾离子与硫酸根;根据n=cV计算钾离子物质的量;
(2)根据m=nM计算二氧化硫质量,根据V=nVm计算二氧化硫体积;
(3)根据n=
计算HCl物质的量,再根据c=
计算物质的量浓度;
(4)根据稀释电离,稀释前后溶质的物质的量不变,据此计算需要1.5mol/L的氯化钠溶液的体积.
(2)根据m=nM计算二氧化硫质量,根据V=nVm计算二氧化硫体积;
(3)根据n=
| V |
| Vm |
| n |
| V |
(4)根据稀释电离,稀释前后溶质的物质的量不变,据此计算需要1.5mol/L的氯化钠溶液的体积.
解答:
解:(1)硫酸钾属于盐,电离产生钾离子与硫酸根,电离方程式为:K2SO4=2K++SO42-;
0.5L,0.5mol/L的硫酸钾溶液中,钾离子浓度为0.5mol/L×2=1mol/L,故钾离子的物质的量=0.5L×1mol/L=0.5mol,
故答案为:K2SO4=2K++SO42-;0.5mol;
根据n=cV计算钾离子物质的量;
(2)0.5molSO2的质量是:0.5mol×64g/mol=32g,在标准状况下,其体积为 0.5mol×22.4L/mol=11.2L,
故答案为:32;11.2;
(3)标准状况下,11.2L HCl的物质的量=
=0.5mol,溶解于水配成500mL的溶液,则溶液的物质的量浓度为
=1mol/L,
故答案为:1mol/L;
(4)设需要1.5mol/L的氯化钠溶液的体积为 x mL,根据稀释电离,稀释前后溶质的物质的量不变,则:
300mL×0.5mol/L=x mL×1.5mol/L,解得x=100,
故答案为:100.
0.5L,0.5mol/L的硫酸钾溶液中,钾离子浓度为0.5mol/L×2=1mol/L,故钾离子的物质的量=0.5L×1mol/L=0.5mol,
故答案为:K2SO4=2K++SO42-;0.5mol;
根据n=cV计算钾离子物质的量;
(2)0.5molSO2的质量是:0.5mol×64g/mol=32g,在标准状况下,其体积为 0.5mol×22.4L/mol=11.2L,
故答案为:32;11.2;
(3)标准状况下,11.2L HCl的物质的量=
| 11.2L |
| 22.4L/mol |
| 0.5mol |
| 0.5L |
故答案为:1mol/L;
(4)设需要1.5mol/L的氯化钠溶液的体积为 x mL,根据稀释电离,稀释前后溶质的物质的量不变,则:
300mL×0.5mol/L=x mL×1.5mol/L,解得x=100,
故答案为:100.
点评:本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
下列有关说法正确的是( )
| A、CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B、将纯水加热至较高温度,水的离子积变大、pH变小、呈中性 |
| C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
| D、水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热过程 |
 设反应①Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数为K1.
设反应①Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数为K1.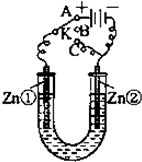 在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图所示:
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图所示: