题目内容
下列实验的现象与对应结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 常温下将铁片分别放在浓硝酸和稀硝酸中 | 在浓硝酸中无明显变化,稀硝酸中有气泡 | 稀硝酸的氧化性比浓硝酸强 |
| B | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
| C | 将水蒸气通过灼热的铁粉 | 铁粉变成红棕色粉末 | 铁与水在高温下发生反应 |
| D | 常温下将Al片放入浓硫酸中 | 无明显变化 | Al与浓硫酸不反应 |
| A、A | B、B | C、C | D、D |
考点:铁的化学性质,钠的化学性质
专题:元素及其化合物
分析:A.浓硝酸具有强氧化性,可与铁发生钝化反应;
B.乙醇含有羟基,可与钠发生反应生成氢气;
C.铁和水蒸气反应生成四氧化三铁,颜色为黑色;
D.常温下,铝和浓硫酸发生钝化反应.
B.乙醇含有羟基,可与钠发生反应生成氢气;
C.铁和水蒸气反应生成四氧化三铁,颜色为黑色;
D.常温下,铝和浓硫酸发生钝化反应.
解答:
解:A.浓硝酸具有强氧化性,可与铁发生钝化反应,浓硝酸的氧化性比稀硝酸强,故A错误;
B.乙醇含有羟基,可与钠发生反应生成氢气,故B正确;
C.铁和水蒸气反应生成四氧化三铁,颜色为黑色,故C错误;
D.浓硫酸具有强氧化性,常温下,铝和浓硫酸发生钝化反应,故D错误.
故选B.
B.乙醇含有羟基,可与钠发生反应生成氢气,故B正确;
C.铁和水蒸气反应生成四氧化三铁,颜色为黑色,故C错误;
D.浓硫酸具有强氧化性,常温下,铝和浓硫酸发生钝化反应,故D错误.
故选B.
点评:本题综合考查元素化合物知识,题目贴近高考,且为高频考点,注重基础知识的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
相关题目
关于物质的用途说法错误的是( )
| A、甲烷是家用天然气的主要成分 |
| B、氯气可用于制取漂白粉 |
| C、晶体硅是制造光导纤维的主要原料 |
| D、碳酸氢钠可作发酵剂 |
T℃时,将气体X与气体Y置于一密闭容器中,反应生成气体Z,反应过程中各物质的 浓度变化如图(Ⅰ)所示.保持其它条件不变,在T1、T2两种温度下,Y的体积分数变化如图(Ⅱ)所示,下列结论正确的是( )
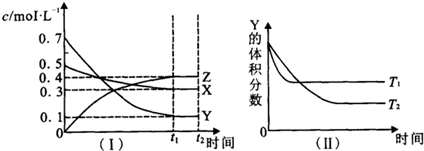

| A、图(Ⅱ)中T1>T2,则正反应是吸热反应 |
| B、t2 min时,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
| C、其它条件不变,升高温度,正、逆反应速率均增大,且X的转化率增大 |
| D、T℃时,若密闭容器中各物质起始浓度为:0.4mol?L-1 X、0.4mol?L-1 Y、0.2mol/L Z保持其他条件不变,达到平衡时z的浓度为0.4 mol?L-1 |
蒸干下列物质可以得到溶质本身的是( )
| A、AlCl3溶液 |
| B、NaHCO3溶液 |
| C、Fe2(SO4)3溶液 |
| D、CuCl2溶液 |
下列物质的分类合理的是( )
| A、酸:H2S、H2O、H2SO4、H2CO3 |
| B、碱:NaOH、KOH、Ba(OH)2、Cu2(OH)2CO3 |
| C、铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3?H2O |
| D、氧化物:CO2、NO、SO2、H2O |
下列有关溶液性质的叙述,正确的是( )
| A、强电解质在水中溶解度一定大于弱电解质 |
| B、让一束光线通过蛋白质溶液,会产生丁达尔现现象 |
| C、75mL 2mol/L氯化铵溶液的c(Cl-)与50mL 1 mol/L氯化锅溶液中的c(Cl-)相等 |
| D、浓度为1mol/L的醋酸溶液lL,欲使其浓度变为2mol/L,将溶液加热蒸发浓缩至0.5L |
分类法是学习和研究化学的一种常用的科学方法.下列分类合理的是( )
| A、根据分子中含有的氢原子的个数将酸分为一元酸、二元酸等 |
| B、根据反应中的能量变化,将化学反应分为:“化合,分解,置换,复分解”四类 |
| C、根据溶液导电能力的强弱,将电解质分为强电解质和弱电解质 |
| D、KOH和NH3?H2O都是碱 |