题目内容
11.某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:A.在250 mL容量瓶中配制250 mL烧碱溶液
B.用碱式滴定管量取25 mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为M mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
回答下列问题:
(1)正确的操作步骤顺序中B前面是A、D后面是E(用字母填写).
(2)滴定读数应注意:滴定管与水平的实验台面垂直,并使刻度线与滴定管液面的凹液面最低点相切.
(3)操作D中液面应调整到零刻度或零稍下的某一刻度的某一刻度.
(4)滴定到终点时锥形瓶内溶液的pH约为3.1~4.4;终点时的颜色变化是溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色.
(5)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响偏高
(6)该烧碱样品的纯度计算式是$\frac{0.8m({V}_{2}-{V}_{1})}{W}$×100%.
分析 (1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定;
(2)滴定管垂直,液面不再变化时才可读数,视线与溶液凹液面最低点相平,注意滴定管的精确值;
(3)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,为减小误差,尖嘴部分应充满液体,无气泡;
(4)指示剂为甲基橙,变色范围为3.1-4.4;
(5)因标准液浓度变小,用量变大;
(6)根据反应消耗的硫酸,求出氢氧化钠,进一步求出样品的纯度.
解答 解:(1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定,
故答案为:A;E;
(2)滴定管垂直,液面不再变化时才可读数,视线与溶液凹液面最低点相平,滴定管读数准确到0.01ml,
故答案为:垂直;凹液面最低点;
(3)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,故答案为:零刻度或零稍下的某一刻度;
(4)指示剂为甲基橙,变色范围为3.1-4.4,终点时pH约为4,溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色;
故答案为:3.1~4.4;溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色;
(5)若酸式滴定管没有用标准H2SO4润洗,则标准液浓度变小,用量变大,
故答案为:偏高;
(7)滴到消耗的硫酸为:n(硫酸)=cV=(V2-V1)×10-3L×m mol/L,根据反应方程可知,n(NaOH)=2n(硫酸)=2m(V2-V1)×10-3mol,
所以原来样品中氢氧化钠的物质的量为:2m(V2-V1)×10-3mol×$\frac{250}{25}$=2m(V2-V1)×10-2mol,则样品中氢氧化钠的质量为m(NaOH)=nM=80m(V2-V1)×10-2g,则该烧碱样品的纯度为:$\frac{80M(V2-V1)×1{0}^{-2}g}{W}$×100%=$\frac{0.8M(V2-V1)}{W}$×100%,
故答案为:$\frac{0.8M(V2-V1)}{W}$×100%.
点评 本题综合考查酸碱中和滴定,侧重于化学实验基本操作以及物质的含量的测定等问题,题目难度中等,建议在学习中把握相关基本实验方法,学习中注意积累.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案| A. | ρ1>ρ2>ρ3>ρ4 | B. | ρ1>ρ2>ρ4>ρ3 | C. | ρ2>ρ1>ρ3>ρ4 | D. | ρ2>ρ1>ρ4>ρ3 |
| A. | 根据是否具有丁达尔效应,可将分散系分为溶液、浊液和胶体 | |
| B. | SiO2既能与NaOH溶液反应,又能与氢氟酸反应,但SiO2不属于两性氧化物 | |
| C. | AgCl的水溶液不易导电,故AgCl是弱电解质 | |
| D. | 烧碱、纯碱、熟石灰均属于碱 |
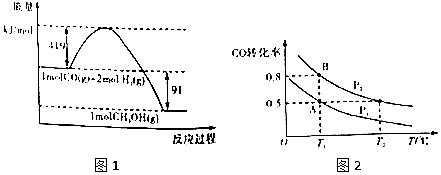
②
| 化学键 | H-H | H-O | O=O |
| 键能kj/mol | 436 | x | 496 |
H2(g)+$\frac{1}{2}$O2(g)=H2O(I)△H=-284kJ/mol
H2O(I)=H2O(g)△H=+44kJ/mol
请回答下列问题:
(1)甲醇气体分解为CO和H2两种气体这一反应的活化能为510kj/mol;
(2)请写出表示气态甲醇燃烧热的热化学方程式CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-757kJ•mol-1;
(3)H-O的键能x值为462;
(4)如图2:在一容积可变的密闭容器中充入10molCO气体和30molH2气体,当达到平衡状态A时,容器的体积为20L.如反应开始时仍充入10molCO和30molH2,则在平衡状态B时容器的体积V(B)=7L;
(5)在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生该反应(起始温度和起始体积相同,反应物和生成物反应前后均为气态).相关数据如表所示:
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1molCO、2molH2 | 1molCH3OH | 1molCH3OH |
| 平衡时容器体积 | V(甲) | V(乙) | V(丙) |
| 反应的平衡常数K | K(甲) | K(乙) | K(丙) |
| 平衡时CH3OH的浓度/mol•L-1 | C(甲) | C(乙) | C(丙) |
| 平衡时CH3OH的反应速率/mol•L-1•min-1 | v(甲) | v(乙) | v(丙) |
A.V(甲)>V(丙)B.K(乙)>K(丙)
C.c(乙)>c(甲) D.v(甲)=v(丙)
| A. | Mg(OH)2+2HCl═MgCl2+2H2O | B. | 2NaOH+H2SO4═Na2SO4+2H2O | ||
| C. | Ba(OH)2+H2SO4═BaSO4↓+2H2O | D. | CH3COOH+NaOH═CH3COONa+H2O |
 ,
,