题目内容
10. 塑化剂是一种对人体有害的物质,增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得.下列说法正确的是( )
塑化剂是一种对人体有害的物质,增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得.下列说法正确的是( )| A. | 环己醇能与溴水发生取代反应 | |
| B. | 1molDCHP可与2molNaOH完全反应 | |
| C. | DCHP与邻苯二甲酸酐均含有酯基,所以它们互为同系物 | |
| D. | DCHP易溶于水 |
分析 A.环己醇不能与溴水反应;
B.DCHP中含-COOC-,发生水解生成羧酸与碱反应;
C.DCHP与邻苯二甲酸酐结构不同;
D.DCHP属于酯类物质.
解答 解:A.环己醇不能与溴水反应,羟基可被HBr取代,故A错误;
B.DCHP中含-COOC-,发生水解生成羧酸与碱反应,则1 molDCHP最多可与含2 molNaOH的烧碱溶液反应,故B正确;
C.DCHP与邻苯二甲酸酐结构不同,不是同系物,故C错误;
D.DCHP属于酯类物质,不溶于水,故D错误;
故选B.
点评 本题考查有机物的官能团及性质,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握结构与性质的关系是解答本题的关键,题目难度不大.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
19.设NA为阿伏加徳罗常数的值,下列说法不正确的是( )
| A. | 9.2gNO2和N2O4的混合物中含氮原子数目为0.2NA | |
| B. | 常温常压下,35.5g Cl2与足量的NaOH溶液完全反应,转移的电子数为0.5NA | |
| C. | 标准状况下,2.24LNH3与1.6gCH4分子中所含电子数目均为NA | |
| D. | 已知反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,当生成NA个NH3分子时,反应放出的热量小于46.2kJ |
15.X、Y、Z、R是短周期主族元素,X元素是形成有机化合物的必需元素,Y元素的原子最外层电子数是次外层的三倍,Z元素的原子半径是短周期元素中最大的,R原子的核外电子数是X原子核Z原子的核外电子数之和.下列叙述不正确的是( )
| A. | XY2是形成酸雨的主要污染物 | |
| B. | X、Y、R三种元素的非金属性Y>R>X | |
| C. | X、Z分别与R形成的化合物中化学键类型不同 | |
| D. | 含有Y、Z、R三种元素的化合物溶液可能显碱性 |
1.短周期元素X、Y、Z、M的原子序数依次增大,原子X的L层电子数是K层的2倍,Y2+电子层结构与氖相同,Z原子的质子数为偶数,室温下M单质为淡黄色固体,下列有关说法正确的是( )
| A. | X、Y、Z、M的原子半径依次减小 | |
| B. | Y与M组成化合物的熔点高于X与M组成的化合物 | |
| C. | X、Z、M的最低价气态氢化物的热稳定性依次增强 | |
| D. | X的单质与Y、Z的最高价氧化物均能发生置换反应 |
18.化学反应原理是工业合成氨的重要理论基础.
(1)合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,若在恒温、恒压条件下向平衡体系中通入氩气,平衡向左移动(填“向左”、“向右”或“不”);使用催化剂该反应的△H不变(填“增大”、“减小”或“不变”).
(2)在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
下列说法正确的是BD(填字母编号).
A.2c1>c3 B.a+b=92.4 C.2p2<p3 D.a1+a3<1
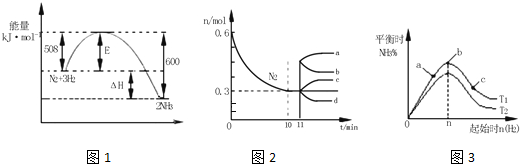
(3)合成氨在等容条件下进行.改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图1所示:

①N2的平均反应速率vI(N2)、vII(N2)、vIII(N2)从大到小排列次序为vI(N2)>vII(N2)>vIII(N2).
②由第一次平衡到第二次平衡,平衡移动的方向是正向移动,采取的措施是降低了生成物浓度或分离出NH3.
③比较第II阶段反应温度(T2)和第III阶段反应温度(T3)的高低:T2>T3(填“>”、“=”或“<”),判断的理由是此反应为放热反应,降低温度,平衡向正反应方向移动,平衡的移动只能减弱改变,不能抵消改变.
(4)将0.1mol N2和0.3mol H2通入一容积可变的容器中进行工业固氮反应.
①若300℃、压强P2时达到平衡,容器容积恰为10L,则此状态下反应的平衡常数K=22.6(mol•L-1)-2(计算结果保留3位有效数字).
②合成氨反应达到平衡后,t1时刻速率发生如图B变化,此刻可能改变的反应条件是加压或缩小容器体积或增大反应物浓度(回答一种).
(1)合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,若在恒温、恒压条件下向平衡体系中通入氩气,平衡向左移动(填“向左”、“向右”或“不”);使用催化剂该反应的△H不变(填“增大”、“减小”或“不变”).
(2)在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| 平衡时NH3的浓度(mol•L-1) | cl | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收bkJ | 吸收c kj |
| 体系压强(pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
A.2c1>c3 B.a+b=92.4 C.2p2<p3 D.a1+a3<1
(3)合成氨在等容条件下进行.改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图1所示:

①N2的平均反应速率vI(N2)、vII(N2)、vIII(N2)从大到小排列次序为vI(N2)>vII(N2)>vIII(N2).
②由第一次平衡到第二次平衡,平衡移动的方向是正向移动,采取的措施是降低了生成物浓度或分离出NH3.
③比较第II阶段反应温度(T2)和第III阶段反应温度(T3)的高低:T2>T3(填“>”、“=”或“<”),判断的理由是此反应为放热反应,降低温度,平衡向正反应方向移动,平衡的移动只能减弱改变,不能抵消改变.
(4)将0.1mol N2和0.3mol H2通入一容积可变的容器中进行工业固氮反应.
①若300℃、压强P2时达到平衡,容器容积恰为10L,则此状态下反应的平衡常数K=22.6(mol•L-1)-2(计算结果保留3位有效数字).
②合成氨反应达到平衡后,t1时刻速率发生如图B变化,此刻可能改变的反应条件是加压或缩小容器体积或增大反应物浓度(回答一种).

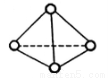 ),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN
),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。