题目内容
6.下列不熊说明氯元素的非金属性比硫元素的强的有几项:①HCl比H2S稳定:②HClO的氧化性比H2SO4强③HClO4的非羟基氧数目比H2SO4的非羟基氧数目多;④Cl2能与H2S反应生成S;⑤Cl原子最外层有7个电子,S原子最外层有6个电子;⑥Cl2与Fe反应生成FeCl3,S与Fe生成FeS;⑦HCl的酸性比H2S的酸性强;⑧沸点:H2S>HCl.( )| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
分析 比较非金属性可通过以下角度:①氢化物的稳定性,②与氢气反应的难易程度,③最高价氧化物对应的水化物的酸性,④单质之间的置换反应,⑤对应阴离子的还原性强弱,⑥与变价金属反应的化合价高低等.
解答 解:①元素的非金属性越强,对应的氢化物越稳定,能说明氯元素的非金属性比硫元素的强,故错误;
②比较非金属性的强弱,根据最高价含氧酸的氧化性强弱来比较,最高价含氧酸的酸性越强,则元素的非金属性越强,HClO不是最高价含氧酸,不能说明氯元素的非金属性比硫元素的强,故正确;
③元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,能说明氯元素的非金属性比硫元素的强,HClO4的非羟基氧数目比H2SO4的非羟基氧数目多不能说明氯元素的非金属性比硫元素的强,故正确;
④元素的非金属性越强,对应的单质的氧化性越强,能说明氯元素的非金属性比硫元素的强,故错误;
⑤比较非金属性的强弱不能根据最外层电子数的多少,应根据得电子能力判断,不能说明氯元素的非金属性比硫元素的强,故正确;
⑥元素的非金属性越强,对应的单质的氧化性越强,Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS,说明Cl2的氧化性大于S,则非金属性Cl大于S,能说明氯元素的非金属性比硫元素的强,故错误;
⑦元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,HCl的酸性比H2S的酸性强,不熊说明氯元素的非金属性比硫元素的强,故正确;
⑧沸点:H2S>HCl和氯、硫元素的非金属性强弱之间无关,故错误,
故选C.
点评 本题考查非金属性的比较,学习中注意把握比较非金属性强弱的角度,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.两种碱的混合物共8g与100mL2mol/L的盐酸恰好完全反应,则混合物组成可能是( )
| A. | NaOH、KOH | B. | NaOH、Cu(OH)2 | C. | Fe(OH)2、Cu(OH)2 | D. | Fe(OH)2、Fe(OH)3 |
1.分析下列反应在任何温度下均能自发进行的是( )
| A. | 2N2(g)+O2(g)═2N2O(g)△H=+163 kJ•mol-1 | |
| B. | Ag(s)+$\frac{1}{2}$Cl2(g)═AgCl(s)△H=-127 kJ•mol-1 | |
| C. | HgO(s)═Hg(l)+$\frac{1}{2}$O2(g)△H=+91 kJ•mol-1 | |
| D. | H2O2(l)═$\frac{1}{2}$O2(g)+H2O(l)△H=-98 kJ•mol-1 |
11.乙烷与丙烷的混合气体与足量的氧气混合点燃后,将燃烧产物通过浓硫酸,浓硫酸增重2.04g,使剩余气体再通过足量的过氧化钠,固体质量增加2.24g,则原混合气中乙烷与丙烷的体积比正确的是( )
| A. | 1:1 | B. | 3:5 | C. | 2:3 | D. | 3:2 |
18.某种兴奋剂的结构简式如图所示,有关该物质的说法错误的是( )
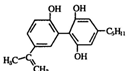

| A. | 该有机物不仅能使溴水、酸性 KMnO4 溶液褪色,也能与FeCl3溶液发生显色反应 | |
| B. | 一定条件下该有机物能发生加成反应、氧化反应、取代反应,也能发生聚合反应 | |
| C. | 该有机物中可能存在手性碳原子 | |
| D. | 该有机物显弱酸性,能与 NaOH 溶液、NaHCO3 溶液发生反应 |
16.分子式为C5H12O,能发生催化氧化生成醛,符合此要求的醇的种类为( )
| A. | 3种 | B. | 4 种 | C. | 5 种 | D. | 8种 |

