��Ŀ����
�������Һ����������֮�������й��ڵ������Һ����������ȷ���ǣ�������
| A��Na2CO3��NaHCO3��������Һ�У����������ͬ | ||
| B�������£�1 mol?L-1��CH3COOH��Һ��1 mol?L-1��NaOH��Һ�������Ϻ����û��Һ�У�c��Na+����c��CH3COO-����c��H+����c��OH-�� | ||
| C�������£�ij��Һ����ˮ�������c��H+��=10-5mol?L-1�������Һ���������� | ||
D�����ʵ���Ũ����ͬ��NH4Cl��NH4HSO4������Һ�У�c��NH
|
���㣺����ˮ���Ӧ��,�����ʱ�Ķ����жϼ��й�ph�ļ���
ר�⣺����ƽ������Һ��pHר��,�����ˮ��ר��
������A��Na2CO3��NaHCO3��������Һ�������Ӷ���Na+��H+��������CO32-��HCO3-��OH-��
B��1 mol?L-1��CH3COOH��Һ��1 mol?L-1��NaOH��Һ��ϣ�������������������Һ��������жϣ�
C�������£�ˮ�����ӻ�Ϊ10-14��ˮ�������c��H+��=c��OH-��=10-7���������Һ����ˮ�ĵ��룻
D�����ʵ���Ũ����ͬ��NH4Cl��NH4HSO4������Һ�У���NH4HSO4��Һ������������笠�����ˮ�⣬NH4Cl��Һ��笠�����ˮ��̶ȴ�
B��1 mol?L-1��CH3COOH��Һ��1 mol?L-1��NaOH��Һ��ϣ�������������������Һ��������жϣ�
C�������£�ˮ�����ӻ�Ϊ10-14��ˮ�������c��H+��=c��OH-��=10-7���������Һ����ˮ�ĵ��룻
D�����ʵ���Ũ����ͬ��NH4Cl��NH4HSO4������Һ�У���NH4HSO4��Һ������������笠�����ˮ�⣬NH4Cl��Һ��笠�����ˮ��̶ȴ�
���
�⣺A��Na2CO3��NaHCO3��������Һ�������Ӷ���Na+��H+��������CO32-��HCO3-��OH-����A����
B��1 mol?L-1��CH3COOH��Һ��1 mol?L-1��NaOH��Һ��ϣ�������������������Һ��������жϣ�����������Һ������ԭ��B����
C�������£�ˮ�����ӻ�Ϊ10-14��ˮ�������c��H+��=c��OH-��=10-7���������Һ����ˮ�ĵ��룬����Һ��c��H+��=10-5mol?L-1��ˮ�ĵ���̶ȳ̶ȣ������Һ�����������ᣬ������ǿ�������Σ���C����
D�����ʵ���Ũ����ͬ��NH4Cl��NH4HSO4������Һ�У�NH4HSO4��Һ������������笠�����ˮ�⣬NH4Cl��Һ��笠�����ˮ��̶ȴ�D��ȷ��
��ѡ��D��
B��1 mol?L-1��CH3COOH��Һ��1 mol?L-1��NaOH��Һ��ϣ�������������������Һ��������жϣ�����������Һ������ԭ��B����
C�������£�ˮ�����ӻ�Ϊ10-14��ˮ�������c��H+��=c��OH-��=10-7���������Һ����ˮ�ĵ��룬����Һ��c��H+��=10-5mol?L-1��ˮ�ĵ���̶ȳ̶ȣ������Һ�����������ᣬ������ǿ�������Σ���C����
D�����ʵ���Ũ����ͬ��NH4Cl��NH4HSO4������Һ�У�NH4HSO4��Һ������������笠�����ˮ�⣬NH4Cl��Һ��笠�����ˮ��̶ȴ�D��ȷ��
��ѡ��D��
���������⿼����Һ������Ũ�ȵĴ�С�Ƚϣ��Ѷ��еȣ�����Ũ�ȱȽϣ�ע�⿼�ǵ��롢ˮ�⡢ˮ�ĵ��롢���غ㡢����غ㡢���Ӻ��ʽ�ȣ�

��ϰ��ϵ�д�
 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�
�����Ŀ
��0.3mol KCl��0.2mol Cu��NO3��2��0.1mol AgNO3һ������ˮ�����100mL�����Һ���ö��Ե缫���һ��ʱ�������һ������9.6g Cu����ʱ����һ���ϲ����������������״����Ϊ��������
| A��2.24 L |
| B��3.92 L |
| C��3.36 L |
| D��2.8 L |
�ִ����������ԡ����ڿ�����Ⱦ��Ϊ��־�ĵ�������Ⱦʱ��?���²��������ڿ�����Ⱦ���ǣ�������
| A�����ʱ���������� |
| B��������̼����������ɵ�����ЧӦ |
| C��ʯ���ͷų��ķ������к����� |
| D�������ϼ��ͷų��ļ�ȩ���к����� |
����������ʱ�������г�����O3�����ɣ�����˵���в���ȷ���ǣ�������
| A��O2��O3��Ϊͬ�������� |
| B��O3����3����ԭ�ӹ��ɵĻ����� |
| C��O2��O3�ת�����ڻ�ѧ�仯 |
| D��O3��Ħ������Ϊ48g��mol-1 |
����˵���������ǣ�������
| A����X+��Y2-�ĺ�����Ӳ�ṹ��ͬ����ԭ��������X��Y |
| B����ˮ��Һ�����ԣ�HCI��H2S�����ƶϳ�Ԫ�صķǽ����ԣ�CI��S |
| C�����ǻ�����ȩ�е���ڶ��ǻ�����ȩ����Ϊ�γ��˷�������� |
| D��H-F��H-O��H-N���ֹ��ۼ��ļ�������ǿ |
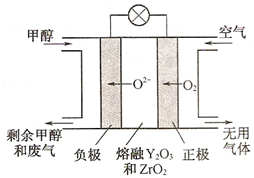
 ����Ӧ����㷺�Ľ���֮һ�����Ļ�������������������Ҳ��������;��
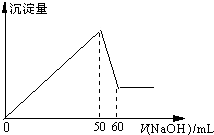
����Ӧ����㷺�Ľ���֮һ�����Ļ�������������������Ҳ��������;��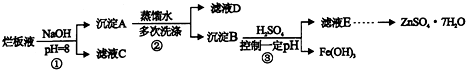
 �밴Ҫ��ش��������⣮
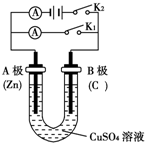
�밴Ҫ��ش��������⣮