��Ŀ����
��NA��ʾ�����ӏ�������ֵ������˵����ȷ���ǣ�������
| A�����³�ѹ�£�2.24L ���������������������Һ��ȫ��Ӧת�Ƶĵ�����Ϊ0.1NA |
| B��30g����ͼ�ȩ�Ļ��������ԭ����ΪNA |
| C��25��ʱ��2L0.1mol/L��Na2CO3��Һ�к��е�CO32-����Ϊ0.2 NA |
| D��ij�ܱ�������ʢ��0.2molSO2��0.1molO2����һ�������³�ַ�Ӧ������SO3������Ϊ0.2 NA |
���㣺�����ӵ�����
ר�⣺
������A�����³�ѹ�£�����Ħ���������22.4L/mol��
B����������ͼ�ȩ�����ʽ��ΪCH2O�������CH2O�����ʵ���n=
��
C��CO32-�����������ˮ��Һ�л�ˮ�⣻
D��SO2��O2�ķ�Ӧ�ǿ��淴Ӧ�����ܽ��г��ף�
B����������ͼ�ȩ�����ʽ��ΪCH2O�������CH2O�����ʵ���n=
| m |
| M |
C��CO32-�����������ˮ��Һ�л�ˮ�⣻
D��SO2��O2�ķ�Ӧ�ǿ��淴Ӧ�����ܽ��г��ף�
���
�⣺A�����³�ѹ�£�����Ħ���������22.4L/mol����A����
B������ͼ�ȩ�����ʽ��ΪCH2O���ʻ������CH2O�����ʵ���n=
=
=1mol���ʺ��е���ԭ��Ϊ1mol����B��ȷ��
C��CO32-�����������ˮ��Һ�л�ˮ�⣬�ʺ��е�CO32-����С��0.2 NA����C����
D��SO2��O2�ķ�Ӧ�ǿ��淴Ӧ�����ܽ��г��ף�������SO3������С��0.2 NA����D����
��ѡB��
B������ͼ�ȩ�����ʽ��ΪCH2O���ʻ������CH2O�����ʵ���n=
| m |
| M |
| 30g |
| 30g/mol |
C��CO32-�����������ˮ��Һ�л�ˮ�⣬�ʺ��е�CO32-����С��0.2 NA����C����
D��SO2��O2�ķ�Ӧ�ǿ��淴Ӧ�����ܽ��г��ף�������SO3������С��0.2 NA����D����
��ѡB��
���������⿼���˰���٤���������йؼ��㣬�������չ�ʽ��ʹ�ú����ʵĽṹ�ǽ���ؼ����ѶȲ���

��ϰ��ϵ�д�
�����Ŀ
�ڵؿ��к������ķǽ����뺬�����Ľ����γɵĻ������ǣ�������
| A��CaO |
| B��Fe2O3 |
| C��Na2O |
| D��Al2O3 |
�ִ����������ԡ����ڿ�����Ⱦ��Ϊ��־�ĵ�������Ⱦʱ��?���²��������ڿ�����Ⱦ���ǣ�������
| A�����ʱ���������� |
| B��������̼����������ɵ�����ЧӦ |
| C��ʯ���ͷų��ķ������к����� |
| D�������ϼ��ͷų��ļ�ȩ���к����� |
����������ɳ����ԭ�����͵��ǣ�������
�ٺ���ɫNO2��ѹ����ɫ�ȱ�����dz
��SO2��������SO3�ķ�Ӧ��������������Ŀ���
��Fe��SCN��3��Һ�м������KSCN����ɫ����
����ˮ�˱����ڵ��¡��ܹ������¡�
�����������ڼ���������ˮ���������������ˮ���������
�ٺ���ɫNO2��ѹ����ɫ�ȱ�����dz
��SO2��������SO3�ķ�Ӧ��������������Ŀ���
��Fe��SCN��3��Һ�м������KSCN����ɫ����
����ˮ�˱����ڵ��¡��ܹ������¡�
�����������ڼ���������ˮ���������������ˮ���������
| A���٢ڢ� | B���ڢۢ� |
| C���٢ڢۢ� | D��ȫ�� |
�������ӷ���ʽ��������ʵ�������ȷ���ǣ�������
| A��Ư����Һ�ڿ�����ʧЧ��ClO-+CO2+H2O=HClO+HCO3- | ||||
B����Ũ������MnO2��Ӧ��ȡ����������MnO2+2H++2Cl-
| ||||
| C����NaAlO2��Һ��ͨ�����CO2��Al��OH��3��AlO2-+CO2+2H2O=Al��OH��3��+HCO3- | ||||
| D��ϡ�������ͭƬ�ϣ�Cu+2H+��Cu2++H2�� |
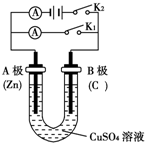 �밴Ҫ��ش��������⣮
�밴Ҫ��ش��������⣮