题目内容
为了探究原电池和电解池的工作原理,某研究性学习小组分别用图14所示的装置进行实验.据图回答问题.
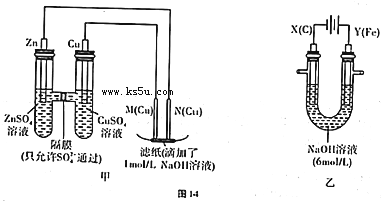
I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填序号).A.石墨B.镁 C.银D.铂
(2)实验过程中,SO42- (填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象有 .
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色:停止实验观察到铁电极明显变细,电解液仍然澄清.查阅资料知,高铁酸银(FeO
)在溶液中呈紫红色.请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极溶液的pH (填“增大”“减小”或“不变”)
(4)电解过程中,Y极发生的电极反应为4OH--4e-=2H2O+O2↑和 .
(5)电解进行一段时间后,若在X极收集到672mL气体,Y电极(铁电极)质量减小0.28g,则在Y极收集到气体为 mL(均已折算为标准状况时气体体积).
(6)K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应为:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为 .

I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是
(2)实验过程中,SO42-
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色:停止实验观察到铁电极明显变细,电解液仍然澄清.查阅资料知,高铁酸银(FeO
2- 4 |
(3)电解过程中,X极溶液的pH
(4)电解过程中,Y极发生的电极反应为4OH--4e-=2H2O+O2↑和
(5)电解进行一段时间后,若在X极收集到672mL气体,Y电极(铁电极)质量减小0.28g,则在Y极收集到气体为
(6)K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应为:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为
考点:原电池和电解池的工作原理,电解原理
专题:电化学专题
分析:Ⅰ图1中,左边装置是原电池,较活泼的金属锌作负极,较不活泼的金属铜作正极,如果要找电极材料代替铜,所找材料必须是不如锌活泼的金属或导电的非金属,M是阳极,N是阴极,电解池中阴极上阳离子得电子发生还原反应,原电池放电时,阴离子向负极移动;
Ⅱ该电解池中,阳极材料是活泼金属,则电解池工作时,阳极上铁失电子发生氧化反应,同时氢氧根离子失电子生成氧气,阴极上氢离子得电子发生还原反应,根据阴阳极上转移电子数相等计算铁反应的质量,在碱性锌电池中,正极上得电子发生还原反应.
Ⅱ该电解池中,阳极材料是活泼金属,则电解池工作时,阳极上铁失电子发生氧化反应,同时氢氧根离子失电子生成氧气,阴极上氢离子得电子发生还原反应,根据阴阳极上转移电子数相等计算铁反应的质量,在碱性锌电池中,正极上得电子发生还原反应.
解答:
解:(1)在保证电极反应不变的情况下,仍然是锌作负极,则正极材料必须是不如锌活泼的金属或导电的非金属,镁是比锌活泼的金属,所以不能代替铜,故选:B;
(2)原电池放电时,阴离子向负极移动,所以硫酸根从右向左移动,电解池中,阴极上氢离子得电子生成氢气,阳极上铁失电子生成亚铁离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化生成氢氧化铁,所以滤纸上有红褐色斑点产生,故答案为:从右向左,滤纸上有红褐色斑点产生;
(3)电解过程中,阴极上氢离子放电生成氢气,则阴极附近氢氧根离子浓度大于氢离子溶液,溶液呈碱性,溶液的pH增大,故答案为:增大;
(4)铁是活泼金属,电解池工作时,阳极上铁失电子发生氧化反应,氢氧根离子失电子发生氧化反应,所以发生的电极反应式为:Fe-6e-+8OH-═FeO42-+4H2O和4OH--4e-═2H2O+O2↑,
故答案为:4OH--4e-═2H2O+O2↑;
(5)X电极上析出的是氢气,2H++2e-═H2↑,当收集到672mL气体即
=0.03mol气体时,转移电子的量是0.06mol,铁质量减少为0.28g即0.005mol,转移电子是0.03mol,所以产生氧气转移电子是0.03mol,根据电极反应式:4OH--4e-═2H2O+O2↑,转移电子0.03mol生成氧气是0.0075mol,体积是0.0075mol×22.4L/mol=0.168L=168mL,故答案为:168;
(6)Y电极上析出的是氧气,且Y电极失电子进入溶液,铁质量减少为0.28g即0.005mol,根据转移电子数相等得正极上高铁酸根离子得电子发生还原反应,反应方程式为2FeO42-+6e-+5H2O═Fe2O3+10OH-,
故答案为:2FeO42-+6e-+5H2O═Fe2O3+10OH-.
(2)原电池放电时,阴离子向负极移动,所以硫酸根从右向左移动,电解池中,阴极上氢离子得电子生成氢气,阳极上铁失电子生成亚铁离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化生成氢氧化铁,所以滤纸上有红褐色斑点产生,故答案为:从右向左,滤纸上有红褐色斑点产生;
(3)电解过程中,阴极上氢离子放电生成氢气,则阴极附近氢氧根离子浓度大于氢离子溶液,溶液呈碱性,溶液的pH增大,故答案为:增大;
(4)铁是活泼金属,电解池工作时,阳极上铁失电子发生氧化反应,氢氧根离子失电子发生氧化反应,所以发生的电极反应式为:Fe-6e-+8OH-═FeO42-+4H2O和4OH--4e-═2H2O+O2↑,
故答案为:4OH--4e-═2H2O+O2↑;
(5)X电极上析出的是氢气,2H++2e-═H2↑,当收集到672mL气体即
| 0.672L |
| 22.4L/mol |
(6)Y电极上析出的是氧气,且Y电极失电子进入溶液,铁质量减少为0.28g即0.005mol,根据转移电子数相等得正极上高铁酸根离子得电子发生还原反应,反应方程式为2FeO42-+6e-+5H2O═Fe2O3+10OH-,
故答案为:2FeO42-+6e-+5H2O═Fe2O3+10OH-.
点评:本题考查了原电池和电解池原理,注意:电解池中如果活泼金属作阳极,则电解池工作时阳极材料失电子发生氧化反应,为易错点.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
 普通水泥在固化过程中自由水分子减少并产生Ca(OH)2使溶液呈碱性.根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间.此方法的原理如图所示,反应的总方程式为:2Cu+Ag2O═2CuO+2Ag,下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少并产生Ca(OH)2使溶液呈碱性.根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间.此方法的原理如图所示,反应的总方程式为:2Cu+Ag2O═2CuO+2Ag,下列有关说法正确的是( )| A、电池工作时,OH-向正极移动 |
| B、测量原理示意图中,Ag2O为负极 |
| C、电流方向是从Ag2O/Ag电极到Cu电极 |
| D、正极的电极反应为:2Cu+2OH--2e-═Cu2O+H2O |
下列说法正确的是( )
| A、双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境没有污染 |
| B、新制备的氯水中只存在三种分子、三种离子 |
| C、10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% |
| D、浓硝酸与浓盐酸一样,在空气中出现白雾 |
某铁柱需长期浸入水下,为了减少腐蚀,下列措施中不能达到目的是( )
| A、在铁柱上铆上一些锌片 |
| B、制造铁柱时,向铁中渗入一定比例的铜制成合金 |
| C、在铁柱表面涂上一层较厚的沥青 |
| D、在铁柱表面镀锡 |
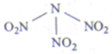 科学家最近研制出可望成为高效火箭液态推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,用NA表示阿伏加德罗常数,下列有关N(NO2)3的说法正确的是]( )
科学家最近研制出可望成为高效火箭液态推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,用NA表示阿伏加德罗常数,下列有关N(NO2)3的说法正确的是]( )| A、分子中四个氮原子共平面 |
| B、7.6 g N(NO2)3和N2O3混合物中共含氮原子数为0.2NA |
| C、标准状况下,2.24L N(NO2)3含有的分子数为0.1NA |
| D、15.2g该物质含有0.6NA个非极性键 |
反应 2A=B+3C,在20℃时进行,v(A)=5mol/(L?s),已知每升温10℃,该反应速率增大到原来的2倍,则当其它条件不变而温度升到50℃时,反应速率v(B)是( )
| A、20 mol/(L?s) |
| B、40 mol/(L?s) |
| C、60 mol/(L?s) |
| D、15 mol/(L?s) |
3He与4He互为同位素,下列说法不正确的是( )
| A、3He与4He具有相同的中子数 |
| B、3He与4He具有相同的质子数 |
| C、3He与4He具有相同的最外层电子数 |
| D、3He与4He具有不同的质量数 |