题目内容
NH3(g)燃烧生成NO2 (g)和H2O(g),已知
(1)2H2(g)+O2 (g)=2H2O(g)△H=-483.6kJ?mol-1
(2)N2 (g)+2O2 (g)=2NO2 (g)△H=+67.8kJ?mol-1
(3)N2 (g)+3H2 (g)=2NH3(g)△H=-92.0kJ?mol-1
试计算后写出NH3(g)燃烧的热化学方程式 .
(1)2H2(g)+O2 (g)=2H2O(g)△H=-483.6kJ?mol-1
(2)N2 (g)+2O2 (g)=2NO2 (g)△H=+67.8kJ?mol-1
(3)N2 (g)+3H2 (g)=2NH3(g)△H=-92.0kJ?mol-1
试计算后写出NH3(g)燃烧的热化学方程式
考点:热化学方程式
专题:化学反应中的能量变化
分析:依据热化学方程式和盖斯定律计算得到所需热化学方程式;
解答:
解:依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(1)2H2 (g)+O2 (g)=2H2O(g)△H=-483.6kJ/mol
(2)N2 (g)+2O2 (g)=2NO2 (g)△H=67.8kJ/mol
(3)N2 (g)+3H2 (g)=2NH3(g)△H=-92.0kJ/mol
依据热化学方程式和盖斯定律计算(1)×3-(3)×2+(2)×2得到NH3(g)燃烧生成NO2 (g)和H2O(g) 热化学方程式:4NH3(g)+7O2(g)?4NO2(g)+6H2O(g)△H=-1131.2kJ/mol;
故答案为:4NH3(g)+7O2(g)?4NO2(g)+6H2O(g)△H=-1131.2kJ/mol;
(1)2H2 (g)+O2 (g)=2H2O(g)△H=-483.6kJ/mol
(2)N2 (g)+2O2 (g)=2NO2 (g)△H=67.8kJ/mol
(3)N2 (g)+3H2 (g)=2NH3(g)△H=-92.0kJ/mol
依据热化学方程式和盖斯定律计算(1)×3-(3)×2+(2)×2得到NH3(g)燃烧生成NO2 (g)和H2O(g) 热化学方程式:4NH3(g)+7O2(g)?4NO2(g)+6H2O(g)△H=-1131.2kJ/mol;
故答案为:4NH3(g)+7O2(g)?4NO2(g)+6H2O(g)△H=-1131.2kJ/mol;
点评:本题考查了热化学方程式书写方法和注意问题,主要是热化学方程式和盖斯定律的计算应用,掌握基础是关键,题目较简单.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
离子键的强弱主要决定于离子的半径和离子电荷值.一般规律是:离子半径越小,离子电荷值越大,则离子键越强.K2O、MgO、CaO三种物质中离子键由强到弱的顺序是( )
| A、K2O、MgO、CaO |
| B、MgO、K2O、CaO |
| C、MgO、CaO、K2O |
| D、CaO、MgO、K2O |
下列叙述不正确的是( )
| A、乙醇、乙烯和植物油都能使酸性高锰酸钾褪色 |
| B、乙醇、乙烷、乙酸都可以与钠反应生成氢气 |
C、聚丙烯的结构简式为: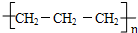 |
| D、用灼烧闻气味的方法可以区分纯棉织物和纯毛织物 |
已知碳酸、亚硫酸、次氯酸的平衡常数如表,下列说法正确的是( )
| H2CO3 | H2SO3 | HClO |
| K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
| K2=5.61×10-11 | K2=1.02×10-7 |
| A、相同条件下,同浓度的NaClO溶液和Na2CO3溶液的碱性,前者更强 |
| B、Na2CO3溶液中通少量SO2:2CO32-+SO2+H2O═2HCO3-+SO32- |
| C、NaHCO3溶液中通少量SO2:2HCO3-+SO2═CO2+SO32-+H2O |
| D、向氯水中分别加入等浓度的NaHCO3和NaHSO3溶液,均可提高氯水中HClO的浓度 |
下列说法一定正确的是( )
A、 1,3,4-三甲苯 1,3,4-三甲苯 |
| B、Na2CO3?10H2O 石碱 |
| C、C3H6 丙烯 |
D、 硫化氢 硫化氢 |
 如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则
如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则