题目内容
反应 2A=B+3C,在20℃时进行,v(A)=5mol/(L?s),已知每升温10℃,该反应速率增大到原来的2倍,则当其它条件不变而温度升到50℃时,反应速率v(B)是( )
| A、20 mol/(L?s) |
| B、40 mol/(L?s) |
| C、60 mol/(L?s) |
| D、15 mol/(L?s) |
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:温度每升高10℃反应速率是原来的2倍,以此计算反应速率.
解答:
解:10℃时以某物质表示的反应速率为5mol/L?s,由温度每升高10℃反应速率是原来的2倍可知,在20℃时进行,v(A)=5mol/(L?s),
30℃、40℃、50℃的反应速率分别为10mol/L?s、20mol/L?s、40mol/L?s;速率之比等于化学方程式计量数之比,v(B)=
v(A)=
×40mol/L?s=20mol/L?s;
故选A.
30℃、40℃、50℃的反应速率分别为10mol/L?s、20mol/L?s、40mol/L?s;速率之比等于化学方程式计量数之比,v(B)=
| 1 |
| 2 |
| 1 |
| 2 |
故选A.
点评:本题考查温度与反应速率的关系,注意把握信息“每升高10℃反应速率是原来的2倍”是解答的关键,题目难度不大.

练习册系列答案
 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
离子键的强弱主要决定于离子的半径和离子电荷值.一般规律是:离子半径越小,离子电荷值越大,则离子键越强.K2O、MgO、CaO三种物质中离子键由强到弱的顺序是( )
| A、K2O、MgO、CaO |
| B、MgO、K2O、CaO |
| C、MgO、CaO、K2O |
| D、CaO、MgO、K2O |
已知碳酸、亚硫酸、次氯酸的平衡常数如表,下列说法正确的是( )
| H2CO3 | H2SO3 | HClO |
| K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
| K2=5.61×10-11 | K2=1.02×10-7 |
| A、相同条件下,同浓度的NaClO溶液和Na2CO3溶液的碱性,前者更强 |
| B、Na2CO3溶液中通少量SO2:2CO32-+SO2+H2O═2HCO3-+SO32- |
| C、NaHCO3溶液中通少量SO2:2HCO3-+SO2═CO2+SO32-+H2O |
| D、向氯水中分别加入等浓度的NaHCO3和NaHSO3溶液,均可提高氯水中HClO的浓度 |
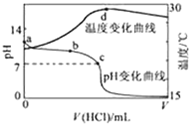 室温下,将1.000mol?L-1盐酸滴入20.00mL 1.000mol?L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol?L-1盐酸滴入20.00mL 1.000mol?L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A、a点由水电离出的c(H+)=1.0×10-14mol/L |
| B、a、b之间可能出现:c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
| C、c点:c(Cl-)═c(NH4+) |
| D、d点后,溶液温度略下降的主要原因是NH3?H2O电离吸热 |
甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成.已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;②0.1mol/L乙溶液中c(H+)>0.1mol/L;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成.下列结论不正确的是( )
| A、甲溶液含有Ba2+ |
| B、乙溶液含有SO42- |
| C、丙溶液含有NH4+ |
| D、丁溶液含有HCO3- |
下列说法一定正确的是( )
A、 1,3,4-三甲苯 1,3,4-三甲苯 |
| B、Na2CO3?10H2O 石碱 |
| C、C3H6 丙烯 |
D、 硫化氢 硫化氢 |
室温时,在指定溶液中能大量共存的一组离子或分子是( )
| A、使pH试纸显深红色的溶液:NH4+、Mg2+、Cl-、NO3- |
| B、能使淀粉碘化钾试纸显蓝色的溶液:NH4+、Cu2+、S2-、SO42- |
| C、0.1mol.L-1碱溶液:Al3+、Fe3+、SO42-、Cl2 |
| D、由水电离的c(H+)=10-12mol?L-1的溶液:K+、Na+、SiO32-、HCO3- |