题目内容
在某温度下,将H2(g)和I2(g)各0.10mol混合物充入10L的密闭容器中,充分反应生成HI气体,达到平衡时,测得c(H2)=0.0080mol/L,求:
(1)反应的平衡常数和H2的转化率
(2)其它条件不变,充入的H2 (g)和I2(g)各0.20mol,求达平衡时各物质的平衡浓度.
(1)反应的平衡常数和H2的转化率
(2)其它条件不变,充入的H2 (g)和I2(g)各0.20mol,求达平衡时各物质的平衡浓度.
考点:化学平衡的计算
专题:化学平衡专题
分析:达到平衡时,测得c(H2)=0.0080mol/L,则 H2(g)+I2(g)?2HI(g)
起始时各物质的浓度(mol?L-1) 0.010 0.010 0
各物质的浓度变化量(mol?L-1) 0.0020 0.0020 0.0040
平衡时各物质的浓度(mol?L-1) 0.0080 0.0080 0.0040
(1)利用平衡的浓度计算K,K为生成物浓度幂之积与反应物浓度幂之积的比;
(2)设转化的氢气为x,利用三段法得出各物质的平衡浓度,平衡常数与(1)相同,以此来计算.
起始时各物质的浓度(mol?L-1) 0.010 0.010 0
各物质的浓度变化量(mol?L-1) 0.0020 0.0020 0.0040
平衡时各物质的浓度(mol?L-1) 0.0080 0.0080 0.0040
(1)利用平衡的浓度计算K,K为生成物浓度幂之积与反应物浓度幂之积的比;
(2)设转化的氢气为x,利用三段法得出各物质的平衡浓度,平衡常数与(1)相同,以此来计算.
解答:
解:达到平衡时,测得c(H2)=0.0080mol/L,则 H2(g)+I2(g)?2HI(g)
起始时各物质的浓度(mol?L-1) 0.010 0.010 0
各物质的浓度变化量(mol?L-1) 0.0020 0.0020 0.0040
平衡时各物质的浓度(mol?L-1) 0.0080 0.0080 0.0040
(1)平衡时c(H2)=c(I2)=0.0080mol/L,c(HI)=0.0040mol/L,
则K=
=0.25,
氢气转化率=
×100%=20%
答:该反应的平衡常数为0.25,H2的转化率20%;
(2)此温度下,起始量分别是c(H2)=0.02mol/L、c(I2)=0.02mol/L,
则 H2(g)+I2(g)?2HI(g)
起始时各物质的浓度(mol?L-1) 0.02 0.02 0
各物质的浓度变化量(mol?L-1) x x 2x
平衡时各物质的浓度(mol?L-1) 0.02-x 0.02-x 2x
K=
=0.25,
解得:x=0.004 mol/L,
所以平衡时c(HI)=0.008mol?L-1,c(H2)=0.0160mol/L,c(I2)=0.0160mol/L
答:化学平衡时HI(g)的平衡浓度为0.008mol/L,氢气和碘蒸气浓度为0.0160mol/L.
起始时各物质的浓度(mol?L-1) 0.010 0.010 0
各物质的浓度变化量(mol?L-1) 0.0020 0.0020 0.0040
平衡时各物质的浓度(mol?L-1) 0.0080 0.0080 0.0040
(1)平衡时c(H2)=c(I2)=0.0080mol/L,c(HI)=0.0040mol/L,
则K=
| (0.0040)2 |
| 0.0080×0.0080 |
氢气转化率=
| 0.0020mol/L |
| 0.010mol/L |
答:该反应的平衡常数为0.25,H2的转化率20%;
(2)此温度下,起始量分别是c(H2)=0.02mol/L、c(I2)=0.02mol/L,
则 H2(g)+I2(g)?2HI(g)
起始时各物质的浓度(mol?L-1) 0.02 0.02 0
各物质的浓度变化量(mol?L-1) x x 2x
平衡时各物质的浓度(mol?L-1) 0.02-x 0.02-x 2x
K=
| (2x)2 |
| (0.02-x)2 |
解得:x=0.004 mol/L,
所以平衡时c(HI)=0.008mol?L-1,c(H2)=0.0160mol/L,c(I2)=0.0160mol/L
答:化学平衡时HI(g)的平衡浓度为0.008mol/L,氢气和碘蒸气浓度为0.0160mol/L.
点评:本题考查化学平衡的计算,明确化学平衡的三段法计算格式及平衡常数的计算方法是解答本题的关键,注意利用平衡浓度计算平衡常数,题目难度中等.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
相同温度下,根据三种酸的电离常数,下列判断正确的是( )
| 酸 | HX | HY | HZ |
| 电常数 | 9×10-7 | 9×10-6 | 10-2 |
| A、三种酸的强弱关系:HX>HY>HZ |
| B、反应 HZ+Y-═HY+Z-够发生 |
| C、相同温度下,0.1 mol?L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大 |
| D、相同温度下,1 mol?L-1HX溶液的电离常数大于0.1 mol?L-1HX |
下列离子在溶液中能大量存在的( )
| A、K+、MnO4-、Cl-、H+ |
| B、AlO2-、Na+、Al3+、Cl- |
| C、Fe2+、SO42-、Cl-、Na+ |
| D、H+、AlO2-、Na+、Cl- |
恒温下将1molN2和3mol H2 在体积为2L的容器中混合,发生如下反应:N2(g)+3H2(g)?2NH3(g),2s后测得NH3的体积分数为25%,则下列说法中不正确的是( )
| A、用N2浓度的减少表示的平均反应速率为0.2mol?L-1?s-1 |
| B、2s时N2的转化率为40% |
| C、2s时混合气体中n(N2):n(H2):n(NH3)═3:9:4 |
| D、2s时NH3的浓度为0.4mol/L |
漆酚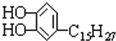 是我国特产漆的主要成分漆酚不应具有的化学性质( )
是我国特产漆的主要成分漆酚不应具有的化学性质( )
 是我国特产漆的主要成分漆酚不应具有的化学性质( )
是我国特产漆的主要成分漆酚不应具有的化学性质( )| A、可以跟Na2CO3溶液反应放出CO2 |
| B、可以使酸性KMnO4溶液褪色 |
| C、可以跟FeCl3溶液发生显色反应 |
| D、可以跟溴水发生取代反应 |
下列有关说法正确的是( )
| A、CFClBrI分子中,各原子最外层均为8个电子 |
| B、含氧酸中,中心原子的化合价越高,其酸性越弱 |
| C、含有共价键的晶体一定具有高的熔、沸点及硬度 |
| D、金属晶体的空间利用率:简单立方堆积>六方最密堆积>体心立方堆积 |
 空气中SO2含量是重要的空气质量指标.在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg?Lˉ1
空气中SO2含量是重要的空气质量指标.在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg?Lˉ1