题目内容
19.NA表示阿伏加德罗常数的值,下列说正确的( )| A. | 17g氨气中所含质子数为10NA | |
| B. | 2.4g金属镁变成镁离子时失去电子数为0.1NA | |
| C. | 在标准状况下,22.4L氧气中所含的氧原子数为NA | |
| D. | 在25℃、压强为1.01×105Pa时,28g氮气所含的分子数为NA |
分析 A.氨气分子中含有10个质子,根据n=$\frac{m}{M}$计算出氨气的物质的量;
B.镁为+2价金属,根据n=$\frac{m}{M}$计算出镁的物质的量;
C.氧气分子为双原子分子,1mol氧气含有2mol氧原子;
D.根据n=$\frac{m}{M}$计算出氮气的物质的量.
解答 解:A.17g氨气的物质的量为:$\frac{17g}{17g/mol}$=1mol,1mol氨气分子中含有10mol质子,所含质子数为10NA,故A正确;
B.2.4g金属镁的物质的量为:$\frac{2.4g}{24g/mol}$=0.1mol,0.1molMg变成镁离子时失去0.2mol电子,失去电子数为0.2NA,故B错误;
C.标准状况下22.4L氧气的物质的量为1mol,1mol氧气分子中含有2mol氧原子,所含的氧原子数为NA,故C错误;
D.28g氮气的物质的量为:$\frac{28g}{28g/mol}$=1mol,1mol氮气中所含的分子数为NA,故D正确;
故选AD.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确清分子、原子、原子核内质子中子及核外电子的构成关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
10.下列实验过程中产生的现象与对应的图形相符合的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
7.下列实验能获得成功的是( )
| A. | 制备溴苯时,将苯与溴水混合,剧烈振荡 | |
| B. | 除去甲烷中混有的二氧化碳时,依次通过烧碱溶液和浓硫酸 | |
| C. | 在酸性高锰酸钾溶液中滴加几滴苯,用力振荡,紫红色褪去 | |
| D. | 在苯中铜氢气制备环己烷 |
14. 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断正确的是( )| A. | 最简单氢化物的稳定性:R>Q>X;R>T>X | |
| B. | 五种元素中Z的活动性最弱,T的氧化物对应水化合物酸性最强 | |
| C. | Q单质能从溶液中置换出X单质,R单质能从溶液中置换出T单质 | |
| D. | X阴离子和T阴离子相比,半径:X阴离子的大;还原性:T阴离子的强 |
4.用NA表示阿伏加德罗常数的值,下列判断正确的是( )
| A. | 44gN2O含有的氮原子数目为NA | |
| B. | 常温常压下,22.4 L N2含有的分子数目为NA | |
| C. | 1 mol Mg变为Mg2+时失去的电子数目为2NA | |
| D. | lmol•L-1K2CO3,溶液中含有的钾离子数目为NA |
11.已知:3H2+N2═2NH3为放热反应,对该反应的下列说法中正确的是( )
| A. | N2和H2的总能量一定大于NH3的总能量 | |
| B. | 因该反应为放热反应,故不必加热就可发生 | |
| C. | N2和H2的总能量一定低于NH3的总能量 | |
| D. | NH3的能量一定高于N2的能量 |
8. 回答以下问题:
回答以下问题:
(1)Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂.推测Ni(CO)4是非极性分子(填“极性”或“非极性”).
(2)已知:波长为300nm的紫外光的光子所具有的能量约为399kJ/mol.根据右表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①N2H4分子中含有极性键的数目是4;NH4+的空间构型是正四面体.
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=-1038.7kJ•mol-1若该反应中有8mol N-H键断裂,则形成的π键有6mol.
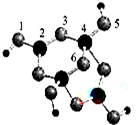
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:
①在Xm-中,硼原子轨道的杂化类型有sp2杂化和sp3杂化;配位键存在于4号与5号原子之间(填原子的数字标号);m=2(填数字).
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有BCD(填序号).
A.共价键 B.离子键 C.氢键 D.范德华力 E.金属键.
 回答以下问题:
回答以下问题:(1)Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂.推测Ni(CO)4是非极性分子(填“极性”或“非极性”).
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①N2H4分子中含有极性键的数目是4;NH4+的空间构型是正四面体.
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=-1038.7kJ•mol-1若该反应中有8mol N-H键断裂,则形成的π键有6mol.
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:
①在Xm-中,硼原子轨道的杂化类型有sp2杂化和sp3杂化;配位键存在于4号与5号原子之间(填原子的数字标号);m=2(填数字).
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有BCD(填序号).
A.共价键 B.离子键 C.氢键 D.范德华力 E.金属键.
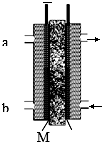 甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.图是甲醇燃料电池模型,试回答下列问题:
甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.图是甲醇燃料电池模型,试回答下列问题: