题目内容
8. 回答以下问题:
回答以下问题:(1)Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂.推测Ni(CO)4是非极性分子(填“极性”或“非极性”).
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①N2H4分子中含有极性键的数目是4;NH4+的空间构型是正四面体.
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=-1038.7kJ•mol-1若该反应中有8mol N-H键断裂,则形成的π键有6mol.
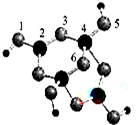
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:
①在Xm-中,硼原子轨道的杂化类型有sp2杂化和sp3杂化;配位键存在于4号与5号原子之间(填原子的数字标号);m=2(填数字).
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有BCD(填序号).
A.共价键 B.离子键 C.氢键 D.范德华力 E.金属键.
分析 (1)分子晶体的熔沸点较低,所以该物质为分子晶体,根据相似相溶原理,其难溶于水,水是极性分子,易溶于有机溶剂,由此分析解;
(2)根据紫外光的光子所具有的能量与蛋白质分子中重要化学键断裂所需能量比较分析;
(3)①1molN2H4分子中含有极性键的数目是4mol的极性键;NH4+中的氮是sp3,空间构型是正四面体结构;
②反应中有4mol N-H键断裂,生成1.5molN2,根据结构式N≡N判断;
(4)①结合化合价代数和为0的原则判断m的值,1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间;
②注意题目要求,钠离子与Xm-形成离子键,结晶水分子间存在氢键和范德华力.
解答 解:(1)分子晶体的熔沸点较低,所以该物质为分子晶体,根据相似相溶原理,其难溶于水,水是极性分子,易溶于有机溶剂,所以是Ni(CO)4是非极性分子,故答案为:非极性;
(2)波长为300nm的紫外光的光子所具有的能量约为399kJ/mol,比蛋白质分子中C-C、C-N和C-S的键能都大,所以波长为300nm的紫外光的光子能破坏蛋白质分子中的化学键,从而破坏蛋白质分子,故答案为:紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子;
(3)①1molN2H4分子中含有极性键的数目是4mol的极性键;NH4+中的氮是sp3,空间构型是正四面体结构,
故答案为:4;正四面体;
②1mol氮气分子中含有2molπ键,若该反应中有8mol-H键断裂,即有2mol肼参加反应,生成3mol氮气,所以形成的π键有3mol×2=6mol,故答案为:6;
(4)①观察模型,可知Xm-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2,
1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间,
故答案为:sp2杂化、sp3杂化;4号与5号;2;
②钠离子与Xm-形成离子键,结晶水分子间存在氢键和范德华力,
故答案为:B C D.
点评 本题考查较为综合,题目难度中等,涉及分子的极性、分子的空间构型、化学键等,(4)为易错点,也是本题难点,答题时要注意审题.

 名校课堂系列答案
名校课堂系列答案| A. | 17g氨气中所含质子数为10NA | |
| B. | 2.4g金属镁变成镁离子时失去电子数为0.1NA | |
| C. | 在标准状况下,22.4L氧气中所含的氧原子数为NA | |
| D. | 在25℃、压强为1.01×105Pa时,28g氮气所含的分子数为NA |
①BrO3-+6I-+6H+=3I2+Br-+3H2O ②2BrO3-+I2=2IO3-+Br2
③IO3-+5I-+6H+=3I2+3H2O ④2IO3-+10Br-+12H+=I2+5Br2+6H2O
实验如下:
| 步骤 | 现象 |
| ⅰ.向盛有30mL 0.2mol•L-1 KI溶液的锥形瓶中依次 滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为 蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |
(1)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是BrO3->IO3->Br2>I2;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是BrO3-+5Br-+6H+=3Br2+3H2O.
(2)若用y表示锥形瓶中含碘物质的物质的量,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标).

| A. | 除去乙烷中少量的乙烯:催化条件下通入H2 | |
| B. | 除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 | |
| D. | 除去乙醇中少量的乙酸:加足量生石灰、蒸馏 |
| A. | 2s | B. | 5f | C. | 2d | D. | 3px |
A.反应物浓度等于生成物浓度
B.容器中N2、H2、NH3浓度之比为1:3:2
C.v(N2正)=v(H2正)
D.v(N2正):v(NH3正)=1:2
E.v(N2正):v(H2逆)=1:3
F.v(H2正):v(NH3逆)=2:3
G.单位时间内生成1mol的N2时,同时生成3mol的H2
H.反应混合体系的压强不随时间的变化而变化
I.容器内气体的密度不再变化
J.平均相对分子量不再变化.
| A. | A B E H J | B. | B E I J | C. | E H J | D. | F H J |
| A. | 一定是一种单质 | B. | 一定是纯净物 | ||
| C. | 可能是混合物也可能是纯净物 | D. | 一定是同位素组成的不同单质 |
| A. | H2Te>H2Se>H2S>H2O | B. | KCl>NaCl>LiCl>HCl | ||
| C. | Sr>Ba>Ca>Be | D. | 金刚石>SiC>晶体硅 |
| A. | 质子数为192 | B. | 中子数为77 | C. | 质量数为115 | D. | 电子数为77 |