题目内容
3.下列叙述正确的是( )| A. | 标准状况下,11.2LSO2气体中含氧原子数等于18g水中含有的氧原子数 | |
| B. | 5.6 g铁与足量稀硫酸反应失去的电子的物质的最为0.3 mol | |
| C. | 100g98%的浓硫酸所含的氧原子个数为4mol | |
| D. | 20gNaOH溶于1L水,所得溶液中c(Na+)=0.5mol•L-1 |
分析 A.根据n=$\frac{V}{Vm}$=$\frac{m}{M}$计算二氧化硫、水的物质的量,结合分子含有的O原子数目解答;
B.铁与稀硫酸反应生成硫酸亚铁;
C.浓硫酸中硫酸、水分子都含有氧原子;
D.溶液的体积不等于水的体积.
解答 解:A.标准状况下,11.2L NO2的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,含有1mol氧原子,18g水的物质的量=$\frac{18g}{18g/mol}$=1mol,也含有1molO原子,故二者含有的氧原子数相等,故A正确;
B.铁与稀硫酸反应生成硫酸亚铁,5.6 g铁物质的量为0.1mol,与足量稀硫酸反应失去的电子的物质的最为0.2mol,故B错误;
C.浓硫酸中硫酸、水分子都含有氧原子,100g98%的浓硫酸所含的氧原子个数大于4mol,故C错误;
D.20gNaOH 溶于1L水,溶液的体积不等于水的体积,所以无法计算离子的浓度,故D错误;
故选:A.
点评 本题考查物质的量有关计算,明确以物质的量为核心计算公式,熟悉物质量浓度中体积指溶液体积,水的体积不等于溶液的体积是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列关于正丁烷的说法错误的是( )
| A. | 能发生取代反应 | B. | 与异丁烷互为同分异构体 | ||
| C. | 能发生氧化反应 | D. | 能反生加成反应 |
14.有机物X的结构如图所示,下列说法正确的是( )


| A. | 1molX最多能与3molNaOH反应 | |
| B. | X能与碳酸钠溶液产生二氧化碳 | |
| C. | 1molX和浓溴水反应时,能消耗3molBr2 | |
| D. | 1molX能最多能与5molH2加成 |
11.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | C、D、E的原子半径:C>D>E | |
| B. | 单质B不存在同素异形体 | |
| C. | 化合物AE与CE具有相同类型的化学键 | |
| D. | 元素C、D的最高价氧化物对应的水化物之间不能发生反应 |
18.下列鉴别方法不可行的是( )
| A. | 用水鉴别乙醇、苯和溴苯 | |
| B. | 用酸性高锰酸钾溶液鉴别苯、已烯、己烷 | |
| C. | 用饱和碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用燃烧法鉴别乙醇、苯和四氯化碳 |
8.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 5.6 g铁粉在足量盐酸中完全溶解,转移电子数为0.3 NA | |
| B. | 0.2 mol浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 7.8 g Na2O2与足量二氧化碳反应转移电子数为0.1NA | |
| D. | NA个HF分于在标准状况下的体积为22.4 L |
15.下列生活用品的主要成分是蛋白质的是( )
| A. | 羽绒被 | B. | 有机玻璃 | C. | 面巾纸 | D. | 涤纶布 |
 .②N2H4•2H2O在水中第一步电离的电离方程式为N2H4•2H2O?[N2H5•H2O]++OH-.
.②N2H4•2H2O在水中第一步电离的电离方程式为N2H4•2H2O?[N2H5•H2O]++OH-.
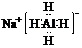 ,遇水剧烈反应产生大量气体,其反应化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑.
,遇水剧烈反应产生大量气体,其反应化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑.