题目内容
7.铝及化合物是中学化学中常见物质,请用所学知识回答下列问题:(1)氢氧化铝是两性氢氧化物,请用电离方程式表示其两性H++AlO2-+H2O?Al(OH)3?Al3++3OH-
(2)NaAlH4是重要的具有研究前景的络合金属络合氢化物,其电子式为
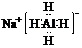 ,遇水剧烈反应产生大量气体,其反应化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑.
,遇水剧烈反应产生大量气体,其反应化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑.(3)以铝土矿为原料,提取氧化铝、冶炼铝的工艺流程如图1

①滤渣1的主要成分为SiO2,试剂B为NaOH溶液
②试剂C为过量CO2气体,则生成沉淀的离子方程式为CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
③电解氧化铝时阳极要定期补充碳粉,原因是电解氧化铝时阳极生成氧气,与碳反应生成二氧化碳
(4)2015年4月《Nature》上刊文,斯坦福大学华裔科学家戴宏杰的团队在实验室成功研制出了在1分钟内充满电,并且重复充放电7500次后仍不衰减的铝离子超级电池(普通锂离子电池只能充电1000多次).该电池还具有能弯曲,不自燃,冲击不爆炸的优异特性.放电时其工作原理简化如图2表示
据此,请写出铝离子超级电池电极方程式
放电时正极:Cn(AlCl4)+e-=Cn+AlCl4-
充电时阴极:4Al2Cl7-+3e-=Al+7AlCl4-
(5)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀.室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6 mol•L-1),需调节溶液pH范围为5.0<PH<7.1.
分析 (1)氢氧化铝是两性氢氧化物,溶液中存在酸式电离和碱式电离,碱式电离生成铝离子和氢氧根离子,酸式电离是生成偏铝酸根离子和氢离子、水;
(2)NaAlH4是离子化合物,铝和氢原子间形成四个共价键,据此写出电子式;遇水剧烈反应产生大量气体是与水反应,结合水电离出的氢氧根离子生成偏铝酸钠和氢气;
(3)由流程可知试剂A的目的是将铝土矿中的金属氧化物溶解,因此试剂A可以是稀硫酸或稀盐酸,滤渣1为二氧化硅,过滤后加入试剂B为NaOH,可除去溶液中的Mg2+、Fe3+,滤渣2为氢氧化镁、氢氧化铁等,滤液中含有NaAlO2,可通入二氧化碳气体,生成氢氧化铝沉淀,经过滤、洗涤、灼烧得到氧化铝,电解熔融的氧化铝,得到铝,以此解答该题,
①由以上分析可知滤渣I的主要成分是SiO2,试剂B为氢氧化钠溶液;
②试剂C为过量CO2气体,和偏铝酸钠溶液反应生成氢氧化铝沉淀;
③电解氧化铝过程中在阳极生成氧气会消耗电极材料石墨
(4)由示意图可知放电时铝为负极,被氧化生成Al2Cl7-,电极方程式为Al+7AlCl4--3e-═4Al2Cl7-,正极反应为3Cn[AlCl4]+3e-=3Cn+3AlCl4-,电解时阳极发生氧化反应,电解方程式为Cn+AlCl4--e-═Cn[AlCl4],阴极发生还原反应,电极方程式为4Al2Cl7-+3e-=Al+7AlCl4-,以此解答该题;
(5)pH=7.1时Mn(OH)2开始沉淀.室温下,除去MnSO4溶液中的Fe3+、Al3+,结合Al(OH)3完全变成沉淀时的pH、Fe(OH)3完全变成沉淀时的pH分析.
解答 解:(1)氢氧化铝是两性氢氧化物,溶液中存在酸式电离和碱式电离,电离方程式为:H++AlO2-+H2O?Al(OH)3?Al3++3OH-,
故答案为:H++AlO2-+H2O?Al(OH)3?Al3++3OH-;
(2)NaAlH4是离子化合物,酸根离子中铝漯河四个氢原子形成四个共价键,电子式为: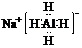 ,遇水剧烈反应产生大量气体是与水反应,结合水电离出的氢氧根离子生成偏铝酸钠和氢气,反应的化学方程式为:NaAlH4+2H2O=NaAlO2+4H2↑,
,遇水剧烈反应产生大量气体是与水反应,结合水电离出的氢氧根离子生成偏铝酸钠和氢气,反应的化学方程式为:NaAlH4+2H2O=NaAlO2+4H2↑,
故答案为: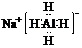 ;NaAlH4+2H2O=NaAlO2+4H2↑;
;NaAlH4+2H2O=NaAlO2+4H2↑;
(3)由流程可知试剂A的目的是将铝土矿中的金属氧化物溶解,因此试剂A可以是稀硫酸或稀盐酸,滤渣1为二氧化硅,过滤后加入试剂B为NaOH溶液,可除去溶液中的Mg2+、Fe3+,滤渣2为氢氧化镁、氢氧化铁等,滤液中含有NaAlO2,可通入过量二氧化碳气体,生成氢氧化铝沉淀和碳酸氢钠,经过滤、洗涤、灼烧得到氧化铝,电解熔融的氧化铝,得到铝,
①分析可知滤渣1为SiO2,试剂B为过量NaOH溶液,可除去溶液中的Mg2+、Fe3+,
故答案为:SiO2;NaOH溶液;
②试剂C为过量CO2气体,和偏铝酸钠溶液反应生成氢氧化铝沉淀,反应的离子方程式为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,
故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
③电解氧化铝时阳极生成氧气,与电极材料石墨即碳反应生成二氧化碳,应在阳极定期补充炭块,
故答案为:电解氧化铝时阳极生成氧气,与碳反应生成二氧化碳;
(4)由示意图可知放电时铝为负极,被氧化生成Al2Cl7-,电极方程式为Al+7AlCl4--3e-═4Al2Cl7-,正极反应为:3Cn[AlCl4]+3e-=3Cn+3AlCl4-,放电时正极电极反应写为Cn(AlCl4)+e-=Cn+AlCl4-,充电时阴极电极反应是发生还原反应,电极反应为:4Al2Cl7-+3e-=Al+7AlCl4-,
故答案为:Cn(AlCl4)+e-=Cn+AlCl4-; 4Al2Cl7-+3e-=Al+7AlCl4-;
(5)pH=7.1时Mn(OH)2开始沉淀.室温下,除去MnSO4溶液中的Fe3+、Al3+,氢氧化铝完全变成沉淀时的pH:Ksp[Al(OH)3]=1×10-33=c(Al3+)×c3(OH-),c(Al3+)=1×10-6mol•L-1,解得:c(OH-)=1×10-9mol•L-1,c(H+)=1×10-5mol•L-1pH=5,同理Fe(OH)3完全变成沉淀时,pH约为3.5,故pH范围是:5.0<pH<7.1,
故答案为:5.0<PH<7.1.
点评 本题以铝化合物的性质为载体综合考查工业冶炼铝、原电池和电解池原理及其电极反应书写、溶度积常数计算等知识,侧重于考查学生分析和解决问题的能力,综合性强,为高考常见题型,注意把握制备原理和反应的流程,题目难度中等.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案| A. | 标准状况下,11.2LSO2气体中含氧原子数等于18g水中含有的氧原子数 | |
| B. | 5.6 g铁与足量稀硫酸反应失去的电子的物质的最为0.3 mol | |
| C. | 100g98%的浓硫酸所含的氧原子个数为4mol | |
| D. | 20gNaOH溶于1L水,所得溶液中c(Na+)=0.5mol•L-1 |
| 试剂或操作 | |
| 鉴别乙醇和乙酸 | |
| 鉴别棉花和蚕丝 | |
| 除去乙烷中混有的乙烯 | |
| 除去苯中溶解的溴单质 | |
| 鉴别植物油和矿物油 |
| 选项 | 实验 | 现象 | 结论 |
| A | 在硫酸亚铁溶液中滴加含NaOH的次氯酸钠溶液 | 产生红褐色沉淀 | 硫酸亚铁已变质 |
| B | 在蔗糖的水解液中滴加银氨溶液,加热 | 没有银镜生成 | 蔗糖未水解 |
| C | 向CaCl2溶液中通入纯净的SO2 | 产生白色沉淀 | CaCl2与SO2反应生成CaSO3 |
| D | 在0.1mol/L AlCl3溶液中滴加少量NaOH溶液,再滴加0.1mol/L FeCl3溶液 | 先产生白色沉淀,后白色沉淀转化成红褐色沉淀 | Ksp[Fe(OH)3]< Ksp[Al(OH)3] |
| A. | A | B. | B | C. | C | D. | D |
| A. | 常温常压下,71g氯气与足量金属钠充分反应,转移的电子数为2 NA | |
| B. | 1.8g的NH4+离子中含有的电子数NA | |
| C. | 常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA | |
| D. | 1 mol/L MgSO4溶液中所含SO42-数目为NA |
| A. | 蒸馏 | B. | 冷却结晶 | C. | 重结晶 | D. | 蒸发结晶 |
| A | B | C | D | 单质E | |
| 熔点(℃) | 801 | 710 | 193 | -68 | 2300 |
| 沸点(℃) | 1456 | 1414 | 183 | 57 | 2500 |
| A. | D固体是共价化合物形成的晶体 | |
| B. | B中的键的强度比A中的键的强度大 | |
| C. | 单质E可能是原子之间由共价键直接形成的晶体 | |
| D. | C固体受热能升华 |
| A. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2+O2 与 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O互为可逆反应 | |
| B. | 可逆反应在一定条件下可达到平衡状态,该状态下,正、逆反应速率相等,都为零 | |
| C. | 可逆反应不能进行到底,必然有反应物剩余 | |
| D. | 可逆反应的速率很小,达到最大限度时反应停止 |