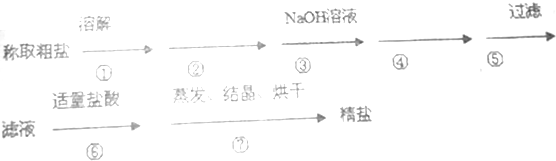
题目内容
4.某有机物结构如图所示,关于该有机物下列说法正确的是( )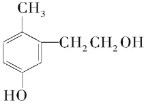
| A. | 它是苯酚的同系物 | |
| B. | 1 mol该物质能与溴水反应消耗2molBr2发生取代反应 | |
| C. | 1 mol该有机物能与足量金属钠反应生成0.5mol H2 | |
| D. | 1 mol该有机物能与2molNaOH反应 | |
| E. | 该物质在加热条件下可以与铜反应生成一种具有醛基的化合物 |
分析 该分子中含有苯环、醇羟基和酚羟基,所以具有苯、醇、酚的性质,能发生氧化反应、加成反应、还原反应、消去反应、酯化反应等,以此解答该题.
解答 解:A.该有机物含有2个羟基,与苯酚结构不同,不是同系物,故A错误;
B.该有机物只有一个邻位H可被取代,则1 mol该物质能与溴水反应消耗1molBr2发生取代反应,故B错误;
C.有机物含有2个羟基,则1 mol该有机物能与足量金属钠反应生成1mol H2,故C错误;
D.只有酚羟基与氢氧化钠反应,则1 mol该有机物能与1molNaOH反应,故D错误;
E.该物质中含有醇羟基,且醇羟基位于边上,所以在铜作催化剂、加热条件下能被氧化为醛基,故E正确.
故选E.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系即可解答,侧重考查醇、酚的考查,注意酚和溴发生取代反应时的位置,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.向某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示.下列说法中正确的是( )
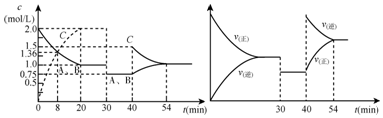

| A. | 30min时降低温度,40min时升高温度 | |
| B. | 8min前A的平均反应速率为0.16mol/(L•min) | |
| C. | 反应方程式中的x=1,正反应为吸热反应 | |
| D. | 20min~40min间该反应的平衡常数均为4 |
15.下列说法正确的是( )
| A. | 甲烷与氯气的混合气体在光照下反应,生成的是一氯甲烷与氯化氢 | |
| B. | 向盛有乙醇的烧杯中投入一小块金属钠,可以观察到钠块沉在乙醇液面下面 | |
| C. | 氯仿能发生水解反应和消去反应 | |
| D. | 乙烯可作水果催熟剂,无水乙醇直接用作医疗消毒剂 |
12.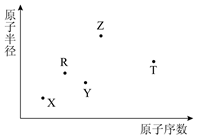 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.Y与Z能形成Z2Y、Z2Y2型离子化合物,R原子最外层电子数是电子层数的2倍,Z与T形成的化合物Z2T能破坏水的电离平衡.下列说法正确的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.Y与Z能形成Z2Y、Z2Y2型离子化合物,R原子最外层电子数是电子层数的2倍,Z与T形成的化合物Z2T能破坏水的电离平衡.下列说法正确的是( )
 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.Y与Z能形成Z2Y、Z2Y2型离子化合物,R原子最外层电子数是电子层数的2倍,Z与T形成的化合物Z2T能破坏水的电离平衡.下列说法正确的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.Y与Z能形成Z2Y、Z2Y2型离子化合物,R原子最外层电子数是电子层数的2倍,Z与T形成的化合物Z2T能破坏水的电离平衡.下列说法正确的是( )| A. | 最高价氧化物对应水化物的酸性R>T | |
| B. | 氢化物的沸点一定是Y>R | |
| C. | 原子半径和离子半径均满足Y<Z | |
| D. | 由X、Y、Z、T四种元素组成的化合物中既含有离子键又含有共价键 |
19.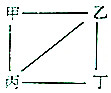 X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“-”相连的两种物质能发生反应).下列判断一定正确的是( )
X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“-”相连的两种物质能发生反应).下列判断一定正确的是( )
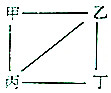 X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“-”相连的两种物质能发生反应).下列判断一定正确的是( )
X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“-”相连的两种物质能发生反应).下列判断一定正确的是( )| A. | X是元素周期表中非金属性最强的元素 | |
| B. | Z位于元素周期表第3周期IA族 | |
| C. | 4种原子中,Y原子半径最大 | |
| D. | W的最高化合价为+7 |
2.已知:A(g)+2B(g)?C(g)+D(g)△H<0,一定温度下,2molA和2molB在2L密闭容器中反应,10min后达到平衡,此时容器压强降为原来的$\frac{4}{5}$,下列叙述正确的是( )
| A. | 从开始到平衡,A的反应速率为0.08mol•L-1•min-1 | |
| B. | 随着反应的进行,混合气体的密度逐渐减小 | |
| C. | 达到平衡时,B的转化率为20% | |
| D. | 该温度下,反应的平衡常数K=$\frac{20}{3}$ |
6.下列物质的检验,其结论一定正确的是( )
| A. | 向某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,白色沉淀不溶解,也无其他现象,说明原溶液中一定含有SO42- | |
| B. | 取少量久置的Na2SO3样品于试管中加水溶解,再加足量盐酸酸化,然后加BaCl2溶液,若加HCl时有气体产生,加BaCl2时有白色沉淀产生,说明Na2SO3样品已部分被氧化 | |
| C. | 向某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32-或SO32- | |
| D. | 将某气体通入品红溶液中,品红溶液褪色,该气体一定是SO2 |
7. Ⅰ、已知 KI溶液在酸性条件下能与氧气反应. 现有以下实验记录:
Ⅰ、已知 KI溶液在酸性条件下能与氧气反应. 现有以下实验记录:
回答下列问题:
(1)该反应的离子方程式为4H++4I-+O2=2I2+2H2O.
(2)该实验的目的是探究温度对反应速率的影响.
(3)实验试剂除了1mol/L KI溶液、0.1mol/L H2SO4溶液外,还需要的试剂是淀粉溶液,实验现象为无色溶液变蓝色.
(4)由上述实验记录可得出的结论是每升高10℃,反应速率增大约2倍
(5)若要进行酸性对反应速率的影响的探究实验,你会采取的措施是保持其他实验条件不变,采用不同浓度的硫酸溶液进行对比实验
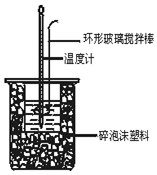
Ⅱ、分别取40mL 0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).实验时,还需测量的数据有ACE.
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
某学生实验记录数据如表:
依据该学生的实验数据计算,该实验测得的中和热为△H=-51.8kJ/mol.
假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比所求中和热相等(填“相等”或“不相等”).
 Ⅰ、已知 KI溶液在酸性条件下能与氧气反应. 现有以下实验记录:
Ⅰ、已知 KI溶液在酸性条件下能与氧气反应. 现有以下实验记录:| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
(1)该反应的离子方程式为4H++4I-+O2=2I2+2H2O.
(2)该实验的目的是探究温度对反应速率的影响.
(3)实验试剂除了1mol/L KI溶液、0.1mol/L H2SO4溶液外,还需要的试剂是淀粉溶液,实验现象为无色溶液变蓝色.
(4)由上述实验记录可得出的结论是每升高10℃,反应速率增大约2倍
(5)若要进行酸性对反应速率的影响的探究实验,你会采取的措施是保持其他实验条件不变,采用不同浓度的硫酸溶液进行对比实验
Ⅱ、分别取40mL 0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).实验时,还需测量的数据有ACE.
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
某学生实验记录数据如表:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比所求中和热相等(填“相等”或“不相等”).