题目内容
 将1mol I2(g)和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2 (g)?2HI(g);△H<0,并达平衡.HI的物质的量分数w(HI)随时间变化如图曲线(Ⅱ)所示:
将1mol I2(g)和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2 (g)?2HI(g);△H<0,并达平衡.HI的物质的量分数w(HI)随时间变化如图曲线(Ⅱ)所示:(1)达平衡时,I2(g)的物质的量浓度为
(2)若改变反应条件,在甲条件下w(HI)的变化如 曲线(Ⅰ)所示,在乙条件下w(HI)的变化如曲线(Ⅲ) 所示.则甲条件可能是
①恒容条件下,升高温度;
②恒容条件下,降低温度;
③恒温条件下,缩小反应容器体积;
④恒温条件下,扩大反应容器体积;
⑤恒温恒容条件下,加入适当催化剂.
(3)现有一定温度下的密闭容器中存在如下反应:2SO2 (g)+O2(g)?2SO3(g) 已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:达平衡状态时,SO2的转化率=
考点:化学平衡的计算,化学平衡的影响因素
专题:
分析:(1)根据碘化氢的体积发生计算平衡时碘化氢的物质的量,再根据碘化氢和碘之间的关系式计算剩余的碘,c(I2)=
;
(2)反应时间缩短,碘化氢的含量不变,说明该条件只改变反应速率不影响平衡,压强和催化剂对该反应平衡无影响;
(3)利用化学平衡三段式解答.
| n(I2)(剩余) |
| V |
(2)反应时间缩短,碘化氢的含量不变,说明该条件只改变反应速率不影响平衡,压强和催化剂对该反应平衡无影响;
(3)利用化学平衡三段式解答.
解答:
解:(1)该反应是一个反应前后气体体积不变的化学反应,所以反应后混合气体的物质的量是3mol,同一容器中各种气体的体积分数等其物质的量分数,所以平衡时碘化氢的物质的量=3mol×0.6=1.8mol,则参加反应的n(I2)=
n(HI),剩余的n(I2)=1mol-1.8mol×
=0.1mol,所以平衡时c(I2)=
=0.05mol/L,
故答案为:0.05mol/L;
(2)在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,反应时间缩短,碘化氢的含量不变,说明该条件只增大了反应速率不影响平衡,增大压强和加入催化剂对该反应平衡无影响,但都增大反应速率,缩短反应时间;在乙条件下w(HI)的变化如曲线(Ⅲ) 所示,反应时间变长,碘化氢的含量不变,说明反应速率减小,平衡不移动,所以是减小压强,即扩大容器体积,故答案为:③⑤;④;
(3)设氧气消耗量为x;
2SO2(g)+O2 (g)?2SO3(g),
起始(mol/L) 0.4 1 0
转化(molL/) 2x x 2x
平衡(mol/L) 0.4-2x 1-x 2x
K=
=19
x=0.16mol/L;
二氧化硫的转化率=
×100%=80%
故答案为:达平衡状态时,SO2的转化率为80%.
| 1 |
| 2 |
| 1 |
| 2 |
| 0.1mol |
| 2L |
故答案为:0.05mol/L;
(2)在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,反应时间缩短,碘化氢的含量不变,说明该条件只增大了反应速率不影响平衡,增大压强和加入催化剂对该反应平衡无影响,但都增大反应速率,缩短反应时间;在乙条件下w(HI)的变化如曲线(Ⅲ) 所示,反应时间变长,碘化氢的含量不变,说明反应速率减小,平衡不移动,所以是减小压强,即扩大容器体积,故答案为:③⑤;④;
(3)设氧气消耗量为x;
2SO2(g)+O2 (g)?2SO3(g),
起始(mol/L) 0.4 1 0
转化(molL/) 2x x 2x
平衡(mol/L) 0.4-2x 1-x 2x
K=
| (2x)2 |
| (0.4-2x)2×(1-x) |
x=0.16mol/L;
二氧化硫的转化率=
| 2×0.16mol/L |
| 0.4mol/L |
故答案为:达平衡状态时,SO2的转化率为80%.
点评:本题考查了化学平衡的相关计算和化学平衡的影响因素,题目难度不大,注意平衡常数的定义和应用.

练习册系列答案
相关题目
已知在标准状况下的四种气体 ①6.72L CH4;②3.01×1023个HCl分子;③13.6克H2S;④0.2molNH3该条件下体积最大和含氢原子数最多的依次是( )
| A、②和① | B、②和④ |
| C、①和④ | D、③和① |
质子核磁共振谱(PMR)是研究有机物分子结构的有效方法之一,每一结构中的等性氢原子在PMR谱都给出了相应的峰(信号),峰的强度与结构中的H原子数成正比.那么,甲酸乙酯在PMR谱中的信号和强度分别应该是( )
| A、两个信号,强度之比为1:1 |
| B、三个信号,强度之比为1:1:1 |
| C、两个信号,强度之比为3:1 |
| D、三个信号,强度之比为3:2:1 |
空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下,其中不正确的是( )


| A、溴在周期表中位于第四周期VIIA族 |
| B、步骤①中用硫酸酸化可抑制Cl2、Br2与水反应 |
| C、步骤④的离子方程式Br2+SO2+H2O=2H++2Br-+SO42- |
| D、步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物可用分液漏斗分离 |
0.1mol有机物A恰好与标准状况下4.48LHCl发生加成反应,得到产物B,该产物最多与0.4mol Cl2在光照条件下发生取代反应,则有机物A可能为( )
| A、C2H2 |
| B、C2H4 |
| C、C2H6 |
| D、C3H6 |
 如图中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为a L.试回答:
如图中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为a L.试回答: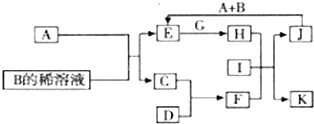 A-L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,0.05mol/LB的溶液pH=1,F具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A-L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,0.05mol/LB的溶液pH=1,F具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.