题目内容
11.下列现象说明SO2具有氧化性的是( )| A. | SO2通入酸性高锰酸钾溶液中使之褪色 | |
| B. | SO2通入石蕊试液中使之变红色 | |
| C. | SO2通入氯水中使之褪色 | |
| D. | SO2通入饱和H2S溶液中析出浅黄色沉淀 |
分析 SO2具有氧化性,则反应中S元素的化合价降低,以此来解答.
解答 解:A.SO2通入高锰酸钾溶液使之褪色,S元素的化合价升高,说明SO2具有还原性,故A不选;
B.SO2通入石蕊试液使其变红色,与水反应生成亚硫酸,SO2具有酸性氧化物的性质,不是氧化还原反应,故B不选;
C.SO2通入氯水使之褪色,反应生成硫酸和盐酸,S元素的化合价升高,说明SO2具有还原性,被氯气氧化为硫酸,故C不选;
D.SO2通入饱和H2S溶液中析出浅黄色沉淀,反应生成S,SO2中S元素的化合价降低,具有氧化性,故D选;
故选D.
点评 本题考查二氧化硫的性质,把握二氧化硫的氧化性、还原性、酸性氧化物的性质为解答的关键,注意从元素的化合价角度分析性质,题目难度不大.

练习册系列答案
相关题目
19.下列说法不正确的是( )
| A. | 氢氧化铝可作胃酸的中和剂 | B. | 碳酸氢钠可作食品的膨松剂 | ||
| C. | 磁性氧化铁可作红色油漆和涂料 | D. | 钠钾合金可作原子反应堆的导热剂 |
6.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 0.5molAl与足量盐酸反应转移电子数为1NA | |
| B. | 标准状况下,22.4L氨气与22.4L氮气所含原子数均为2NA | |
| C. | 7.8gNa2O2所含的离子数为0.3NA | |
| D. | 11.2LCl2完全溶于NaOH溶液,电子转移数为0.5NA |
16.0.3molSO32-恰好将0.2molXO4-离子还原,则X元素在还原产物中的化合价是( )
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
20.在Zn+2HCl═ZnCl2+H2↑反应中,当温度升高时,化学反应速率( )
| A. | 增大 | B. | 减小 | C. | 无法判断 | D. | 不变 |
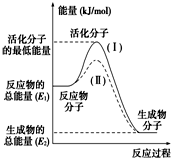 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题:
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题: