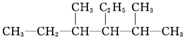题目内容
1.下列叙述错误的是( )| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | 气体摩尔体积在非标准状况下也有可能是22.4L/mol | |
| C. | 在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类 | |
| D. | 物质的量是国际单位制中七个基本物理量之一 |
分析 A.物质含有的微粒可能为单原子、双原子、多原子等;
B.改变温度和压强,气体摩尔体积可能为22.4L/mol;
C.使用物质的量时需要用化学式指明粒子的种类;
D.根据国际单位制中七个基本物理量组成分析.
解答 解:A.1mol任何物质都约含有6.02×1023个微粒,不一定含有6.02×1023个原子,微粒冷凝含有双原子或多原子,故A错误;
B.温度和压强影响气体体积,适当改变温度和氧气,则气体摩尔体积在非标准状况下也有可能是22.4L/mol,故B正确;
C.在使用摩尔表示物质的量的单位时,需要利用其化学式表示其具体存在形式,故C正确;
D.物质的量是一个基本物理量,是国际单位制中七个基本物理量之一,故D正确;
故选A.
点评 本题考查物质的量的应用,题目难度不大,明确物质的量概念及使用方法为解答关键,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
5.将钠、镁、铝各0.3mol分别放入100mL 2mol•L-1的盐酸中,同温同压下产生气体的体积比是( )
| A. | 1:1:1 | B. | 3:2:2 | C. | 1:2:3 | D. | 6:3:2 |
6.下列说法正确的是( )
| A. | 二氧化硫可用于杀菌、消毒 | |
| B. | 煤经过气化和液化等物理变化可转化为清洁能源 | |
| C. | 氯气和明矾均可做自来水的消毒剂 | |
| D. | 食品保鲜剂中所含铁粉和生石灰均作还原剂 |
13.下列事实与胶体性质无关的是( )
| A. | 明矾作净水剂 | |
| B. | 黄河入海口处容易形成沙洲 | |
| C. | 可用半透膜除去淀粉溶液中的少量NaCl | |
| D. | 将植物油倒入水中用力搅拌可形成油水混合物 |
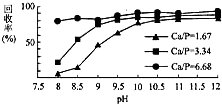 三氯氧磷(POCl3)常温下为无色液体,有广泛应用,近年来,三氯氧磷的工业生产由三氧化磷的“氯气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).
三氯氧磷(POCl3)常温下为无色液体,有广泛应用,近年来,三氯氧磷的工业生产由三氧化磷的“氯气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).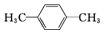 (4)间甲基苯甲醛 (5)CH2=CHCH2CH3(6)
(4)间甲基苯甲醛 (5)CH2=CHCH2CH3(6)