题目内容
20.海带提碘的流程如图:
(1)第②步为了加快溶解速率并使充分进入溶液中,可以采取的措施是:
充分搅拌、加热煮沸(写出两条).
(2)写出第④步发生反应的离子方程式H2O2+2I-+2H+=I2+2H2O.
分析 海带灼烧后加入蒸馏水溶解、过滤,得到滤液中加入过氧化氢和稀硫酸发生氧化还原反应,过氧化氢氧化碘离子生成碘单质,加入四氯化碳萃取分液得到碘单质的四氯化碳溶液,
(1)第②步为了加快溶解速率并使充分进入溶液中可以采取加热、搅拌等措施;
(2)步骤④是过氧化氢酸性溶液中氧化碘离子生成碘单质;
解答 解:(1)为了加快溶解速率并使碘离子充分进入溶液,通过不断搅拌、加热,能加快溶解速度;
故答案为:充分搅拌;加热煮沸;
(2)步骤④是过氧化氢酸性溶液中氧化碘离子生成碘单质,反应的离子方程式为:H2O2+2I-+2H+=I2+2H2O,
故答案为:H2O2+2I-+2H+=I2+2H2O;
点评 本题考查了海水资源的利用,碘单质的提取过程分析和实验操作,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
7.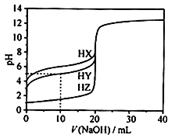 25℃时,用0.1000mol•L-1的NaOH溶液分别滴定20.00mL均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法错误的是( )
25℃时,用0.1000mol•L-1的NaOH溶液分别滴定20.00mL均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法错误的是( )
 25℃时,用0.1000mol•L-1的NaOH溶液分别滴定20.00mL均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法错误的是( )
25℃时,用0.1000mol•L-1的NaOH溶液分别滴定20.00mL均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法错误的是( )| A. | HZ是强酸,HX、HY是弱酸 | |
| B. | 根据滴定曲线,可得Ka(HY)≈10-5 | |
| C. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) | |
| D. | 将上述HY与HZ溶液等体积混合达到平衡时:C(H+)=c(OH-)=c(Z-)+c(Y-) |
11. β-环糊精(简称β-CD)是淀粉部分水解后的产物,其在食品加工、医学及日用化工中的用途非常广泛.下列有关β-CD的说法不正确的是( )
β-环糊精(简称β-CD)是淀粉部分水解后的产物,其在食品加工、医学及日用化工中的用途非常广泛.下列有关β-CD的说法不正确的是( )
 β-环糊精(简称β-CD)是淀粉部分水解后的产物,其在食品加工、医学及日用化工中的用途非常广泛.下列有关β-CD的说法不正确的是( )
β-环糊精(简称β-CD)是淀粉部分水解后的产物,其在食品加工、医学及日用化工中的用途非常广泛.下列有关β-CD的说法不正确的是( )| A. | 有两种含氧官能团 | B. | 酸性条件下能继续水解 | ||
| C. | 相对分子质量为1134 | D. | 其结构中含有20个羟基 |
8.下列气体中,能用排水法收集的是( )
| A. | HCl | B. | NH3 | C. | NO | D. | NO2 |
12.下列过程中发生了加成反应的是( )
| A. | C2H4使酸性高锰酸钾溶液褪色 | B. | C2H4使溴的CCl4溶液褪色 | ||
| C. | 苯的燃烧 | D. | CH4与氯气在光照条件下的反应 |
9. 两个容积均为10L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g),起始物质的量见下表.实验测得两容器不同温度下达到平衡时CO2的物质的量浓度如图所示,下列说法错误的是( )
两个容积均为10L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g),起始物质的量见下表.实验测得两容器不同温度下达到平衡时CO2的物质的量浓度如图所示,下列说法错误的是( )
 两个容积均为10L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g),起始物质的量见下表.实验测得两容器不同温度下达到平衡时CO2的物质的量浓度如图所示,下列说法错误的是( )
两个容积均为10L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g),起始物质的量见下表.实验测得两容器不同温度下达到平衡时CO2的物质的量浓度如图所示,下列说法错误的是( )| 容器 | 起始物质的量 | ||
| NO | CO | ||
| Ⅰ | 1mol | 0.5mol | |
| Ⅱ | 2mol | 1mol | |
| A. | 反应N2(g)+2CO2(g)?2NO(g)+2CO(g)的△H<0,△S>0 | |
| B. | P点的速率比M点慢 | |
| C. | M、N两点容器内的压强:P(M)<2P(N) | |
| D. | N点的平衡常数为44.4 |
10.制备干燥的氨气所需的药品是( )
| A. | NH4Cl溶液、NaOH溶液、碱石灰 | B. | 浓氨水、NaOH固体、浓硫酸 | ||
| C. | NH4Cl固体、消石灰、碱石灰 | D. | 浓NaOH溶液、NH4Cl固体、浓硫酸 |

 ; N2
; N2 .
.