题目内容
19.丙烯酸甲酯是一种重要的工业原料,某实验小组制取丙烯酸甲酯的装置如图1所示: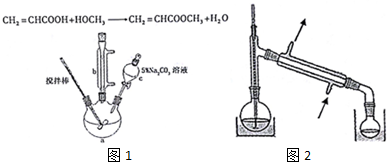
①10.0g丙烯酸和6.0g甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热.
②充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗至中性.
③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70-90℃馏分.
可能用到的信息:
| 沸点 | 溶解性 | ||
| 丙烯酸 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
| 甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
| 丙烯酸丙烯酸甲酯 | 80.5℃ | 难溶于水易溶于有机溶剂 | 易挥发 |
(1)仪器c的名称是分液漏斗.
(2)混合液用5%0Na2CO3溶液洗涤的目的是除去混合液中的丙烯酸和甲醇(降低丙烯酸甲酯的溶解度).
(3)请写出配制100g 5% Na2CO3溶液所使用的玻璃仪器烧杯、玻璃棒、量筒.
(4)关于产品的蒸馏操作(夹持装置未画出),下图中有2处错误,请分别写出温度计水银球位置、尾接管与锥形瓶接口密封.
为检验产率,设计如下实验:
①将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol/L的KOH溶液10-00mL,加热使之完全水解.
②用酚酞做指示剂,向冷却后的溶液中滴加0.5mol/L的HCI溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00mL.
(5)计算本次酯化反应丙烯酸的转化率54.0%.
(6)请列举2条本实验中需要采取的安全防护措施通风橱中实验、防止明火.
分析 (1)根据装置图可知仪器c的名称;
(2)混合液中有丙烯酸甲酯、丙烯酸、甲醇,丙烯酸能与Na2CO3溶液反应,甲醇能溶于碳酸钠溶液中;
(3)配制100g 5% Na2CO3溶液通常用的玻璃仪器是烧杯、玻璃棒、量筒;
(4)蒸馏装置中温度计的水银球应在蒸馏烧瓶的支管口处,尾接管与锥形瓶接口不能密封,据此答题;
(5)中和过量的KOH,滴到终点时共消耗盐酸20.00mL,即0.5×0.02mol=0.01mol,所以用于水解的KOH的物质的量为0.025mol-0.01mol=0.015mol,所以用于生成CH2=CHCOOCH3的CH2=CHCOOH的质量为0.015mol×72g/mol=1.08g,参加实验的样品为原样品的$\frac{1}{5}$,据此可计算丙烯酸的转化率;
(6)丙烯酸和甲醇都是易燃的所以要防止明火,甲醇易挥发,所以要在通风橱中实验.
解答 解:(1)根据装置图可知仪器c的名称为分液漏斗,故答案为:分液漏斗;
(2)混合液中有丙烯酸甲酯、丙烯酸、甲醇,丙烯酸能与Na2CO3溶液反应,甲醇能溶于碳酸钠溶液中,所以用5%0Na2CO3溶液洗涤的目的是除去混合液中的丙烯酸和甲醇(降低丙烯酸甲酯的溶解度),
故答案为:除去混合液中的丙烯酸和甲醇(降低丙烯酸甲酯的溶解度);
(3)配制100g 5% Na2CO3溶液通常用的玻璃仪器是烧杯、玻璃棒、量筒,
故答案为:烧杯、玻璃棒、量筒;
(4)蒸馏装置中温度计的水银球应在蒸馏烧瓶的支管口处,尾接管与锥形瓶接口不能密封,所以装置图中的错为温度计水银球位置、尾接管与锥形瓶接口密封,
故答案为:温度计水银球位置、尾接管与锥形瓶接口密封;
(5)中和过量的KOH,滴到终点时共消耗盐酸20.00mL,即0.5×0.02mol=0.01mol,所以用于水解的KOH的物质的量为0.025mol-0.01mol=0.015mol,所以用于生成CH2=CHCOOCH3的CH2=CHCOOH的质量为0.015mol×72g/mol=1.08g,参加实验的样品为原样品的$\frac{1}{5}$,所以丙烯酸的转化率为$\frac{1.08}{10×\frac{1}{5}}$×100%=54.0%,
故答案为:54.0%;
(6)丙烯酸和甲醇都是易燃的所以要防止明火,甲醇易挥发,所以要在通风橱中实验,所以本实验中需要采取的安全防护措施为通风橱中实验、防止明火,
故答案为:通风橱中实验、防止明火.
点评 本题考查有机物的制备,侧重对化学实验的考查,涉及对装置的理解、物质的分离提纯、对实验条件的控制、对数据的分析处理等,难度中等,需要学生基本知识的基础与灵活运用能力.

相关物质的溶度积常数见表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O.
(2)在空气中直接加热CuCl2•2H2O得不到纯的无水CuCl2,原因是2CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(OH)2•CuCl2+2HCl+2H2O(用化学方程式表示).
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀(发生反应:2Cu2++4I-═2CuI↓+I2).用0.100 0mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉溶液作滴定指示剂,滴定终点的现象是溶液蓝色褪去,且半分钟内不变色.
②该试样中CuCl2•2H2O的质量分数为95%.
(1)实验步骤为:①用托盘天平准确称量4.1g烧碱样品.
②将样品配成250ml待测液,需要的仪器除玻璃棒、量筒、烧杯外还需要的玻璃仪器有250ml容量瓶,胶头滴管.
③用碱式滴定管量取10.00ml待测液,注入锥形瓶中.
④在锥形瓶中滴入2~3滴酚酞或甲基橙(填指示剂),用0.2010mol/L的标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色的变化,直到滴定终点.
(2)该小组测得下列数据
| 滴定次数 | 待测液体积/ml | 标准盐酸体积/ml | |
| 滴定前读数/ml | 滴定后读数/ml | ||
| 第一次 | 10.00 | 0.20 | 22.90 |
| 第二次 | 10.00 | 0.50 | 20.40 |
| 第三次 | 10.00 | 4.00 | 24.10 |
| 第四次 | 10.00 | 0.00 | 20.00 |
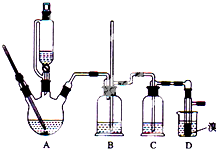 实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(加热及夹持装置省略):
实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(加热及夹持装置省略):| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c(填字母),其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是凝固点较低,过度冷却会使其凝固而使气路堵塞.
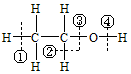 在化学反应中断键位置说法错误的是( )
在化学反应中断键位置说法错误的是( )| A. | 乙醇与钠反应,在④位置断裂,对比钠与水反应,乙醇比水更难电离出氢离子 | |
| B. | 乙醇与浓硫酸在170℃时,在②③位置断裂,以水分子的形式消去,属于消去反应 | |
| C. | 乙醇与浓硫酸在140℃时,在③或④位置断裂,该反应是取代反应 | |
| D. | 乙醇在铜催化下与氧气反应,在②④位置断裂,所以只有与羟基直接相连的碳原子上有氢原子才能发生催化氧化 |
| A. | 异戊二烯分子里的所有原子不可能在同一平面上 | |
| B. | 浓氨水洗涤做过银镜反应的试管 | |
| C. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| D. | 聚合物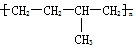 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |