题目内容
一定量的铁与一定量的稀硝酸反应得Fe(NO3)3和Fe(NO3)2之比为1:3.
(1)配平下列方程式:
Fe+ HNO3═ Fe(NO3)3+ Fe(NO3)2+ NO↑+
(2)反应中的氧化产物是 ,被还原的HNO3与未被还原的HNO3的比值为 .
(3)每生成1mol NO,反应中转移的电子为 mol,若此时溶液的体积恰好为2L,则溶液中的NO3-物质的量浓度 mol/L.
(1)配平下列方程式:
(2)反应中的氧化产物是
(3)每生成1mol NO,反应中转移的电子为
考点:氧化还原反应,氧化还原反应方程式的配平
专题:氧化还原反应专题
分析:(1)该反应中Fe元素化合价由0价变为+2价、+3价,N元素化合价由+5价变为+2价,根据转移电子守恒、原子守恒配平方程式;
(2)还原剂对应的产物是氧化产物;生成NO的硝酸是被还原的硝酸,体现酸性的硝酸未被还原;
(3)根据NO和转移电子之间的关系计算,根据原子守恒计算.
(2)还原剂对应的产物是氧化产物;生成NO的硝酸是被还原的硝酸,体现酸性的硝酸未被还原;
(3)根据NO和转移电子之间的关系计算,根据原子守恒计算.
解答:
解:(1)该反应中Fe元素化合价由0价变为+2价、+3价,N元素化合价由+5价变为+2价,Fe(NO3)3和Fe(NO3)2之比为1:3,根据原子守恒知,生成物还有水,根据转移电子守恒、原子守恒配平方程式,该方程式为,4Fe+12HNO3═Fe(NO3)3+3Fe(NO3)2+3NO↑+6H2O,
故答案为:4;12;1;3;3;6H2O;
(2)该反应中铁是还原剂,氧化产物是Fe(NO3)3和Fe(NO3)2;生成NO的硝酸是被还原的硝酸,体现酸性的硝酸未被还原,被还原的HNO3与未被还原的HNO3的比值=9:3=3:1,故答案为:Fe(NO3)3和Fe(NO3)2;3:1;
(3)每生成1mol NO,反应中转移的电子物质的量=1mol×3=3mol,根据方程式知,未被还原的硝酸的物质的量为3mol,则溶液中硝酸根离子浓度=
=1.5mol/L,故答案为:3;1.5.
故答案为:4;12;1;3;3;6H2O;
(2)该反应中铁是还原剂,氧化产物是Fe(NO3)3和Fe(NO3)2;生成NO的硝酸是被还原的硝酸,体现酸性的硝酸未被还原,被还原的HNO3与未被还原的HNO3的比值=9:3=3:1,故答案为:Fe(NO3)3和Fe(NO3)2;3:1;
(3)每生成1mol NO,反应中转移的电子物质的量=1mol×3=3mol,根据方程式知,未被还原的硝酸的物质的量为3mol,则溶液中硝酸根离子浓度=
| 3mol |
| 2L |
点评:本题考查了氧化还原反应,根据元素化合价变化结合原子守恒、转移电子守恒配平方程式,再结合各个物理量之间的关系式解答,题目难度不大.

练习册系列答案
相关题目
“便携式乙醇测量仪”运用燃料电池的工作原理.在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极反应式为:CH3CH2OH+H2O-4e-=X+4H+.下列说法正确的是( )
| A、电池内部H+向负极移动 |
| B、另一极的电极反应式为:O2+4e-+2H2O=4OH- |
| C、X为乙酸 |
| D、乙醇在正极发生反应,电子经过外电路流向负极 |
冶炼下列各组金属时,最适合用H2或CO把它从氧化物中还原出来的是( )
| A、Ca、Mg |
| B、Al、Fe |
| C、Fe、Cu |
| D、Hg、Ag |
 标志垃圾箱的是
标志垃圾箱的是
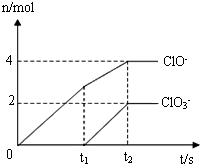 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生反应的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-离子的反应为:6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生反应的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-离子的反应为:6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O.