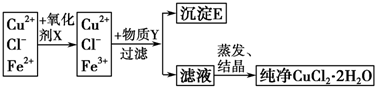
题目内容
9.设NA表示阿伏加德罗常数的值,下列说法中正确的( )①常温常压下,4.6g NO2气体含有的原子总数为0.3NA
②17.6g丙烷中所含的共价键数为4NA个
③1mol Cu和足量稀HNO3反应生成NO 气体,转移电子数是3×6.02×1023
④2gD216O中含有的质子数、中子数、电子数均为NA
⑤常温下,1.0L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
⑥FeCl3溶液中,若Fe3+数目为NA,则Cl-数目等于3NA.
| A. | ①②⑥ | B. | ③④⑤⑥ | C. | ②④⑥ | D. | ①②④ |
分析 ①求出二氧化氮的物质的量,然后根据二氧化氮为三原子分子来分析;
②求出17.6g丙烷的物质的量,然后根据1mol丙烷中含10mol共价键来分析;
③1mol Cu和足量稀HNO3反应失去2mol电子;
④求出2gD216O的物质的量,然后根据D216O中含有的质子数、中子数、电子数均为10个来分析;
⑤在NaOH溶液中,氢离子全部来自于水的电离;
⑥Fe3+是弱碱阳离子,在溶液中会水解.
解答 解:①1个NO2气体分子中含有3个原子,常温常压下,4.6 g NO2气体的物质的量为n=$\frac{4.6g}{46g/mol}$=0.1mol,故含有的原子总数为N=n×3NA=$\frac{m}{M}$×3NA=×3NA=0.3NA,故①正确;
②17.6g丙烷的物质的量为n=$\frac{17.6g}{44g/mol}$=0.4mol,而1mol丙烷中含10mol共价键,故0.4mol丙烷中含4mol共价键即4NA个,故②正确;
③Cu和足量稀HNO3反应后变为+2价,故1mol铜失去2mol电子即2NA个,故③错误;
④2gD216O的物质的量为0.1mol,而D216O中含有的质子数、中子数、电子数均为10个,故0.1mol重水中含质子、中子和电子的个数均为NA个,故④正确;
⑤在NaOH溶液中,氢离子全部来自于水的电离,而水电离出的氢离子和水电离出的氢氧根的个数相同,故pH=13的1L氢氧化钠溶液中,水电离出的氢氧根的物质的量为n=10-13mol/L×1L=10-13mol,故为10-13NA个,故⑤错误;
⑥Fe3+是弱碱阳离子,在溶液中会水解,故当Fe3+数目为NA,则Cl-数目大于3NA.故⑥错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 点燃氢气前,必须验纯 | |
| B. | 大块的金属钠着火,用水浇灭 | |
| C. | 实验结束后,用嘴吹灭酒精灯 | |
| D. | 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 |
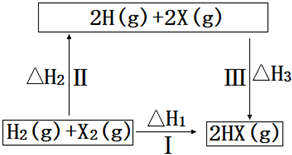
| A. | 2H(g)+2X(g)=2HX(g)△H3<0 | |
| B. | 途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3 | |
| C. | 途径Ⅰ生成HBr放出的热量比生成HCl的少,说明HBr比HCl稳定 | |
| D. | Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次减小 |
| A. | 常温下,0.1 mol•L-1 HA溶液的pH=3,则HA的电离:HA=H++A- | |
| B. | 用铜电极电解饱和硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 向1 mL 2 mol•L-1NaOH溶液中滴加1~2滴0.1 mol•L-1MgCl2溶液后,再滴加2滴0.1 mol•L-1 FeCl3溶液:Mg2++2OH-═Mg(OH)2↓,3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| D. | 钢铁发生吸氧腐蚀生成铁锈:2Fe+O2+2H2O═2Fe(OH)2,4Fe(OH)2+O2+2H2O═4Fe(OH)3,2Fe(OH)3═Fe2O3•xH2O+(3-x)H2O |
| A. | pH=6的NaHSO4溶液:c(Na+)+c(H+)=2c(SO42-)+c(OH-) | |
| B. | 0.1 mol/L NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积不变 | |
| C. | pH相同的①CH3COONa、②NaClO二种溶液的c(Na+):①<② | |
| D. | 0.1 mol/L Na2SO3溶液:c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3) |
| A. | SiO2、SO2均是酸性氧化物,都能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | NO2、CO、NO都是大气污染气体,在空气中都能稳定存在 | |
| D. | 氢氧化钠溶液,纯碱溶液要存放在带磨砂玻璃塞的试剂瓶中 |
| A. | 在空气中燃烧时,硫的燃烧热小,使化学平衡向有利于生成SO3的方向移动 | |
| B. | 在纯氧气中燃烧时,硫的燃烧热大,不利于化学平衡向生成SO3的方向移动 | |
| C. | 在硫燃烧的过程中,对于SO3的生成,温度的影响大于氧气浓度的影响 | |
| D. | 没有使用催化剂 |