题目内容
13.工业和成氨的化学反应为:3H2(g)+N2(g)?2NH3(g)△H<0(1)该反应的化学平衡常数的表达式是K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$.
(2)一定温度下,在容积可变的密闭容器中加入1molN2和3molH2,反应达到平衡后,将混合气体的体积压缩为原来的一半,化学平衡将向正方向移动.重新达到平衡后NH3的体积分数将增大(填“增大”、“减小”或“不变”)
(3)Na2CO3溶液呈碱性,其原因是CO32-+H2O?HCO3-+OH-(用离子方程式表示)
(4)NH4Cl溶液中各种离子浓度由大到小的顺序是:c(Cl-)>c(NH4+)>c(H+)>c(OH-).
(5)在25℃时,用石墨电极电解2.0L 2.5mol/LCuSO4溶液.5min后,在一个石墨电极上有6.4gCu析出.试回答下列问题:
①阳极发生氧化反应,电极反应式为4OH--4e-═2H2O+O2↑,.
②此时得到的O2体积(STP标况)是1.12L,溶液的PH=1.
分析 (1)依据化学方程式和平衡常数的概念写出平衡常数表达式;
(2)体积缩小为原来的一半,压强增大,结合反应前后计量数的不同,判断化学平衡的移动;
(3)碳酸钠为强碱弱酸盐,碳酸根离子水解导致溶液呈碱性;
(4)氯化铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,钠离子不水解,据此判断离子浓度大小;
在25℃时,用石墨电极电解2.0 L,0.5mol/LCuSO4溶液中Cu2+物质的量为0.5mol,5min后,在一个石墨电极上有6.4 g Cu生成物质的量为0.1mol;
(5)①电解过程中,溶液中阴离子OH-、SO42-移向阳极,氢氧根离子放电发生氧化反应,电极反应式:4OH--4e-═2H2O+O2↑;
②依据电极反应电子守恒,生成铜物质的量为0.1mol,电子转移为0.2mol;
阳极反应为:4OH--4e-═2H2O+O2↑
0.2mol 0.2mol 0.05mol
阴极反应为:2Cu2++4e-═2Cu
0.1mol 0.2mol 0.1mol
所以电解过程中电子转移为0.2mol;
生成氧气的体积=0.05mol×22.4L/mol=1.12L;
溶液的PH的计算可以依据水电离出的氢离子和氢氧根离子守恒,减少氢氧根离子0.2mol,溶液中增加氢离子0.2mol,c(H+)=$\frac{0.2mol}{2L}$=0.1mol/L;pH=-lgC(H+)=1.
解答 解:(1)N2(g)+3H2(g)?2NH3(g),平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$,故答案为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$;
(2)体积缩小为原来的一半,压强增大,正反应方向为气体体积减小的方向,化学平衡向右移动,重新达到平衡后生成NH3物质的量增大,体积分数=$\frac{n(N{H}_{3})}{n({N}_{2})+n({H}_{2})+n(N{H}_{3})}$,所以体积分数增大,故答案为:正;增大;
(3)碳酸钠为强碱弱酸盐,钠离子不水解、碳酸根离子水解导致溶液呈碱性,水解离子方程式为:CO32-+H2O?HCO3-+OH-,
故答案为:碱;CO32-+H2O?HCO3-+OH-;
(4)氯化铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,NH4++H2O?NH3.H2O+H+
,所以c(H+)>c(OH-),铵根离子水解、钠离子不水解,所以c(Cl-)>c(NH4+),铵根离子水解较微弱,所以c(NH4+)>c(H+),所以溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(5)①电解过程中,溶液中阴离子OH-、SO42-移向阳极,氢氧根离子放电发生氧化反应,电极反应式:4OH--4e-═2H2O+O2↑,故答案为:阳;4OH--4e-═2H2O+O2↑;
②依据电极反应电子守恒,生成铜物质的量为0.1mol,电子转移为0.2mol;
阳极反应为:4OH--4e-═2H2O+O2↑
0.2mol 0.2mol 0.05mol
阴极反应为:2Cu2++4e-═2Cu
0.1mol 0.2mol 0.1mol
所以电解过程中电子转移为0.2mol;
生成氧气的体积=0.05mol×22.4L/mol=1.12L;
溶液的PH的计算可以依据水电离出的氢离子和氢氧根离子守恒,减少氢氧根离子0.2mol,溶液中增加氢离子0.2mol,c(H+)=$\frac{0.2mol}{2L}$=0.1mol/L;pH=-lgC(H+)=1,故答案为:1.12L;1.
点评 本题考查了盐类水解,根据“谁强谁显性、谁弱谁水解”来确定溶液酸碱性,再结合电荷守恒判断离子浓度大小,题目难度不大.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案| A. | CaO | B. | NH4Cl | C. | H2O | D. | NaCl |
| A. | 酒精 | B. | 次氯酸 | C. | 苯酚 | D. | 甲醛 |
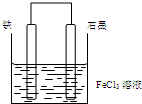
| A. | 电子从石墨棒经外电路流向铁棒 | |
| B. | 总反应为2Fe3++Fe=3 Fe2+ | |
| C. | 石墨电极上发生氧化反应 | |
| D. | 铁电极逐渐变细,石墨电极逐渐变粗 |
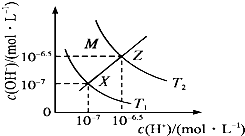
| A. | 由X→Z,c(OH-)增大,所以可以通过加碱来实现 | |
| B. | M区域内任意点均有c(H+)<c(OH-) | |
| C. | T1与T2两条曲线之间的任意点均有c(H+)×c(OH-)=10-14 | |
| D. | XZ线表示c(H+)=c(OH-),溶液显中性,所以XZ线上任意点均有pH=7 |
| A. | H2S→SO2 | B. | Fe2+→Fe | C. | CO→CO2 | D. | 2H+→H2 |
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 加热碳酸氢钠固体时,试管管口倾斜向上 | |
| C. | 实验室制取氯气时,用NaOH溶液进行尾气吸收 | |
| D. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 |
| A. | 5:3 | B. | 4:3 | C. | 3:4 | D. | 3:5 |
| A. | 将SO2通入BaCl2溶液中至饱和,无沉淀产生,再通入过量NH3,产生沉淀 | |
| B. | 二氧化硫可广泛用于食品的增白 | |
| C. | 用AlCl3溶液制取Al(OH)3,沉淀剂选用氨水比选用NaOH溶液好 | |
| D. | 纯锌与稀硫酸反应产生氢气的速率较慢,再加入少量CuSO4固体,反应速率加快 |