题目内容
1.某原电池结构如图所示,下列有关该原电池的说法正确的是( )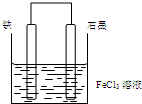
| A. | 电子从石墨棒经外电路流向铁棒 | |
| B. | 总反应为2Fe3++Fe=3 Fe2+ | |
| C. | 石墨电极上发生氧化反应 | |
| D. | 铁电极逐渐变细,石墨电极逐渐变粗 |
分析 因Fe与铁离子可发生Fe+2Fe3+═3Fe2+,形成原电池时,Fe为负极被氧化,C为正极,Fe3+被还原生成Fe2+,电子从负极经外电路流向正极,以此解答该题.
解答 解:A.因Fe与铁离子可发生Fe+2Fe3+═3Fe2+,形成原电池时,Fe为负极被氧化,C为正极,电子从负极经外电路流向正极,即从Fe棒经外电路流向C棒,故A错误;
B.负极是铜失电子发生氧化反应,电极反应为Cu-2e-=Cu2+,正极反应为Fe3++e-=Fe2+,总反应为Fe+2Fe3+═3Fe2+,故B正确;
C.石墨为正极,发生还原反应,故C错误;
D.铁电极为负极被氧化,逐渐变细,石墨电极上是铁离子得电子的过程,产物是亚铁离子,电极质量不变,故D错误.
故选B.
点评 本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的组成条件、工作原理以及电极方程式的书写,难度不大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
11.已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法.
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬. 具体流程如下:

有关离子完全沉淀的pH如下表:
(1)写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式Cr2O72-+6Fe2++14H+═2 Cr3++6Fe3++7H2O.
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.
则在操作②中可用于调节溶液pH的试剂最好为:BD(填序号);
A.Na2O2B.Ca(OH)2C.Ba(OH)2D.NaOH
此时调节溶液的pH范围在C(填序号)最佳.
A.12~14B.10~11C.6~8D.3~4
(3)将等体积的4.0×10-3mol•L-1的AgNO3和4.0×10-3mol•L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式,并简要写出能生成Ag2CrO4沉淀原因的计算过程.
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬. 具体流程如下:

有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.
则在操作②中可用于调节溶液pH的试剂最好为:BD(填序号);
A.Na2O2B.Ca(OH)2C.Ba(OH)2D.NaOH
此时调节溶液的pH范围在C(填序号)最佳.
A.12~14B.10~11C.6~8D.3~4
(3)将等体积的4.0×10-3mol•L-1的AgNO3和4.0×10-3mol•L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式,并简要写出能生成Ag2CrO4沉淀原因的计算过程.
9.常温下加入下列物质,能使溶液中c(CO32-)、c(HCO3-)均降低,而pH增大的是( )
| A. | 氢氧化钠溶液 | B. | 通入二氧化碳 | C. | 氢氧化钙溶液 | D. | 盐酸 |
10.为检验某溶液中是否含有SO42-、NH4+、Cl-、Fe3+等四种离子,某同学进行了下图所示的实验操作,已知检验过程中产生的气体能使湿润红色石蕊试纸变蓝.由该实验能得到的正确结论是( )


| A. | 原溶液中一定含有SO42- | B. | 原溶液中一定含有NH4+ | ||
| C. | 原溶液中一定含有Cl- | D. | 原溶液中一定含有Fe3+ |
11.有A、B、C、D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复).
已知:①A、C溶液的pH均大于7,四种物质的溶液中只有A、B的溶液中水的电离程度均大于纯水的电离程度;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无现象.
(1)A是CH3COONa,B是NH4Cl(填化学式).
(2)写出C和D反应的离子方程式Ba2++SO42-=BaSO4↓.
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
(4)在一定体积的0.005mol•L-1的C溶液中,加入一定体积的0.00125mol•L-1的盐酸,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是1:4.
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、OH-、Cl-、SO42- |
(1)A是CH3COONa,B是NH4Cl(填化学式).
(2)写出C和D反应的离子方程式Ba2++SO42-=BaSO4↓.
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
(4)在一定体积的0.005mol•L-1的C溶液中,加入一定体积的0.00125mol•L-1的盐酸,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是1:4.
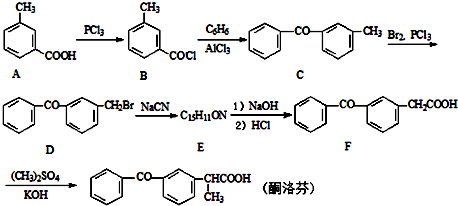
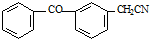 ;由C→D的反应类型是取代反应.
;由C→D的反应类型是取代反应.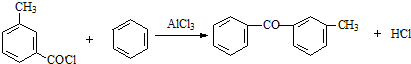 .
. .
.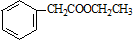 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{NaOH溶液}{→}$CH3CH2OH
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{NaOH溶液}{→}$CH3CH2OH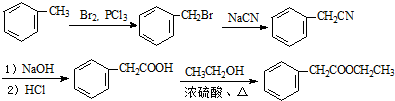 .
.