题目内容
烃A可以发生下列过程所示的变化:
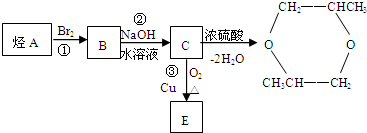
(1)反应①的化学方程式 .
(2)反应②的化学方程式 .
(3)反应③的化学方程式是 .

(1)反应①的化学方程式
(2)反应②的化学方程式
(3)反应③的化学方程式是
考点:有机物的推断
专题:有机物的化学性质及推断
分析:由C在浓硫酸、加热条件下脱去2分子水的生成物结构,可知C为CH3CH(OH)CH2OH,逆推可知,B为CH3CH(Br)CH2Br,A为为CH3CH=CH2,C发生发生催化氧化生成E为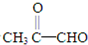 ,据此解答.
,据此解答.
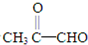 ,据此解答.
,据此解答.解答:
解:由C在浓硫酸、加热条件下脱去2分子水的生成物结构,可知C为CH3CH(OH)CH2OH,逆推可知,B为CH3CH(Br)CH2Br,A为为CH3CH=CH2,C发生发生催化氧化生成E为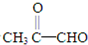 ,
,
(1)反应①的化学方程式为: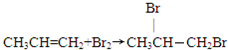 ;
;
(2)反应②的化学方程式为: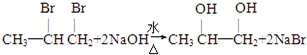 ;
;
(3)反应③的化学方程式是: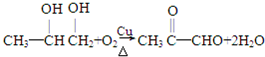 ,
,
故答案为: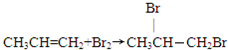 ;
;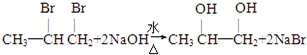 ;
;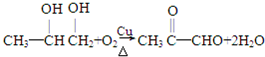 .
.
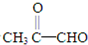 ,
,(1)反应①的化学方程式为:
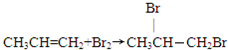 ;
;(2)反应②的化学方程式为:
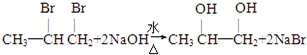 ;
;(3)反应③的化学方程式是:
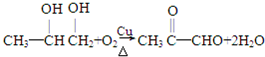 ,
,故答案为:
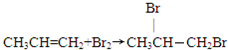 ;
;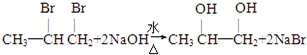 ;
;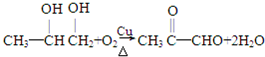 .
.
点评:本题考查有机物推断,涉及烯烃、卤代烃、醇的性质与转化,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
下列有关烷烃的命名正确的是( )
A、 异戊烷 异戊烷 |
B、 2,2,3-三甲基戊烷 2,2,3-三甲基戊烷 |
C、 2-甲基丁烷 2-甲基丁烷 |
| D、(CH3CH2)2CHCH3 3-甲基戊烷 |
乙醇可以发生下列反应,在反应中乙醇分子断裂C-O键而失去羟基的是( )
| A、乙醇在浓硫酸存在下发生消去反应 |
| B、乙醇与金属钠反应 |
| C、乙醇的酯化反应 |
| D、乙醇在铜丝存在条件下发生催化氧化 |
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的是( )
A、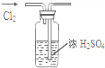 干燥Cl2 干燥Cl2 |
B、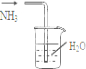 吸收NH3 |
C、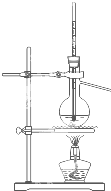 制取蒸馏水 |
D、 吸收SO2 吸收SO2 |
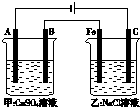 如图为相互串联的甲、乙两个电解池(电极都是惰性电极),请回答:
如图为相互串联的甲、乙两个电解池(电极都是惰性电极),请回答:


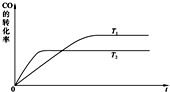 煤间接液化是煤化工的一种重要方法:首先将原料煤与氧气、水蒸汽反应将煤全部气化,制得的粗煤气经变换、脱硫、脱碳制成洁净的合成气(CO+H2),然后合成气在催化剂作用下发生合成反应生成烃类,如:[nCO+(2n+1)H2=CnH2n+2+nH2O];或者合成醇类,如合成甲醇:CO(g)+2H2(g)?CH3OH(g).等等.
煤间接液化是煤化工的一种重要方法:首先将原料煤与氧气、水蒸汽反应将煤全部气化,制得的粗煤气经变换、脱硫、脱碳制成洁净的合成气(CO+H2),然后合成气在催化剂作用下发生合成反应生成烃类,如:[nCO+(2n+1)H2=CnH2n+2+nH2O];或者合成醇类,如合成甲醇:CO(g)+2H2(g)?CH3OH(g).等等.