题目内容
关于各组溶液中微粒浓度的关系正确的是( )
| A、等物质的量的NaClO和NaHCO3的混合溶液中一定有:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| B、将一定量氨气通入0.1mol?L-1 NH4Cl溶液中可能有:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C、向CH3COONa溶液中滴加稀盐酸至中性时有:c(Cl-)>c(Na+)>c(CH3COOH) |
| D、等浓度等体积的CH3COOH溶液和CH3COONa溶液混合均匀后:c(CH3COO-)+c(CH3COOH)=c(Na+) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
B.如果溶液呈碱性,则c(OH-)>c(H+),再根据电荷守恒判断;
C.醋酸钠为强碱弱酸盐,其溶液呈碱性,要使混合溶液呈中性,需要加入少量稀盐酸;
D.溶液中存在物料守恒,根据物料守恒判断.
B.如果溶液呈碱性,则c(OH-)>c(H+),再根据电荷守恒判断;
C.醋酸钠为强碱弱酸盐,其溶液呈碱性,要使混合溶液呈中性,需要加入少量稀盐酸;
D.溶液中存在物料守恒,根据物料守恒判断.
解答:
解:A.任何电解质溶液中都存在物料守恒,根据物料守恒得c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)=c(Na+),故A正确;
B.如果溶液呈碱性,则c(OH-)>c(H+),再结合电荷守恒得c(Cl-)<c(NH4+),故B错误;
C.醋酸钠为强碱弱酸盐,其溶液呈碱性,要使混合溶液呈中性,需要加入少量稀盐酸,根据物料守恒得c(Cl-)<c(Na+),故C错误;
D.溶液中存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=2c(Na+),故D错误;
故选A.
B.如果溶液呈碱性,则c(OH-)>c(H+),再结合电荷守恒得c(Cl-)<c(NH4+),故B错误;
C.醋酸钠为强碱弱酸盐,其溶液呈碱性,要使混合溶液呈中性,需要加入少量稀盐酸,根据物料守恒得c(Cl-)<c(Na+),故C错误;
D.溶液中存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=2c(Na+),故D错误;
故选A.
点评:本题考查了离子浓度大小比较,涉及弱电解质的电离和盐类水解,再结合电荷守恒、物料守恒来分析解答,为学习难点和考试热点,题目难度中等.

练习册系列答案
相关题目
用铜锌合金制成的黄铜制品常被误作黄金.下列方法不能区分其真伪的是( )
| A、观察外表 | B、放入硝酸中 |
| C、测定密度 | D、放入盐酸中 |
工业上利用铝粉除去含氮废水中的NO3-,当控制溶液pH=10.7左右时,所得产物中氮气和氨气的物质的量之比为4:1,则除去含0.1mol NO3-的废水所消耗铝粉的质量至少为( )
| A、3.53g |
| B、4.80g |
| C、5.04g |
| D、8.64g |
室温时,0.1mol?L-1的HA溶液的pH=3,向该溶液中逐滴加入NaOH,在滴加过程中,有关叙述正确的是( )
| A、原HA溶液中,c(H+)=c(OH-)+c(A-) |
| B、当滴入少量的NaOH,促进了HA的电离,溶液的pH增大 |
| C、当恰好完全中和时,溶液呈中性 |
| D、当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) |
下列离子方程式正确的是( )
| A、氮化镁投入过量盐酸 Mg3N2+6H+═3Mg2++2NH3↑ |
| B、用硫氰化钾溶液检验溶液中的Fe3+:Fe3++3SCN-═Fe(SCN)3↓ |
| C、用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+═Cu2++2H2O |
| D、硫酸铜溶液中滴加过量的氨水:Cu2++2 NH3?H2O═Cu(OH)2↓+2NH4+ |
如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )


| A、Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
| B、简单离子的半径:X>Z>M |
| C、由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D、Z单质不能从M与R元素构成的盐溶液中置换出单质M |
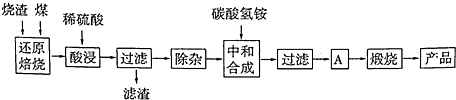
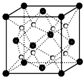 (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.