题目内容
(1)用下列物质:H2O、H2O2、Ba(OH)2、Na2O2、MgCl2、CO2填空.
①只存在离子键的是 .
②由离子键和极性键构成的是 .
(2)某微粒的原子结构示意图为: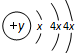
①若该微粒为原子,它是 .(填元素符号)
②若该微粒为带两个电荷的阴离子,该元素在元素周期表中的位置是 .
③若该微粒为带一个电荷的阳离子,它是 .(填名称)
①只存在离子键的是
②由离子键和极性键构成的是
(2)某微粒的原子结构示意图为:
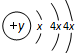
①若该微粒为原子,它是
②若该微粒为带两个电荷的阴离子,该元素在元素周期表中的位置是
③若该微粒为带一个电荷的阳离子,它是
考点:离子化合物的结构特征与性质,原子结构示意图,原子结构与元素的性质
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性共价键;
(2)根据原子核外电子排布式规则知x=2、则该微粒核外有18个电子,原子中核外电子数=核内质子数=原子序数,阳离子中原子序数=核内质子数=核外电子数+电荷数,阴离子中原子序数=核内质子数=核外电子数-电荷数.
(2)根据原子核外电子排布式规则知x=2、则该微粒核外有18个电子,原子中核外电子数=核内质子数=原子序数,阳离子中原子序数=核内质子数=核外电子数+电荷数,阴离子中原子序数=核内质子数=核外电子数-电荷数.
解答:
解:(1)H2O中H原子和O原子之间只存在极性键,为共价化合物;
H2O2中H原子和O原子之间存在极性键、O原子和O原子之间存在非极性共价键,为共价化合物;
Ba(OH)2中钡离子和氢氧根离子之间存在离子键,O原子和H原子之间存在极性共价键,为离子化合物;
Na2O2中钠离子和过氧根离子之间存在离子键,O原子和O原子之间存在非极性共价键,为离子化合物;
MgCl2中镁离子和氯离子之间只存在离子键,为离子化合物;
CO2中C原子和O原子之间只存在极性键,为共价化合物;
①氯化镁是由镁离子和氯离子构成的,只含离子键,为离子化合物,故答案为:MgCl2;
②通过以上分析知,由离子键和极性共价键构成的化合物是Ba(OH)2,故答案为:Ba(OH)2;
(2)根据原子核外电子排布式规则知x=2、则该微粒核外有18个电子,
①原子中核外电子数=核内质子数=原子序数,则原子序数是18的为Ar,故答案为:Ar;
②阴离子中原子序数=核内质子数=核外电子数-电荷数=18-2=16,所以该元素是S元素,S位于第三周期第VIA族,故答案为:第三周期ⅥA;
③阳离子中原子序数=核内质子数=核外电子数+电荷数=18+1=19,则该元素是钾元素,该微粒是钾离子,故答案为:钾离子.
H2O2中H原子和O原子之间存在极性键、O原子和O原子之间存在非极性共价键,为共价化合物;
Ba(OH)2中钡离子和氢氧根离子之间存在离子键,O原子和H原子之间存在极性共价键,为离子化合物;
Na2O2中钠离子和过氧根离子之间存在离子键,O原子和O原子之间存在非极性共价键,为离子化合物;
MgCl2中镁离子和氯离子之间只存在离子键,为离子化合物;
CO2中C原子和O原子之间只存在极性键,为共价化合物;
①氯化镁是由镁离子和氯离子构成的,只含离子键,为离子化合物,故答案为:MgCl2;
②通过以上分析知,由离子键和极性共价键构成的化合物是Ba(OH)2,故答案为:Ba(OH)2;
(2)根据原子核外电子排布式规则知x=2、则该微粒核外有18个电子,
①原子中核外电子数=核内质子数=原子序数,则原子序数是18的为Ar,故答案为:Ar;
②阴离子中原子序数=核内质子数=核外电子数-电荷数=18-2=16,所以该元素是S元素,S位于第三周期第VIA族,故答案为:第三周期ⅥA;
③阳离子中原子序数=核内质子数=核外电子数+电荷数=18+1=19,则该元素是钾元素,该微粒是钾离子,故答案为:钾离子.
点评:本题考查了化学键及微粒的判断,根据物质的构成微粒及微粒间的作用力判断化学键,根据质子数和电子数的关系确定微粒,知道原子、阴阳离子中核外电子数的计算方法,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,依次通过的洗气瓶中盛放的试剂最好为( )
| A、澄清石灰水、浓硫酸 |
| B、KMnO4酸性溶液、浓硫酸 |
| C、溴水、浓硫酸 |
| D、浓硫酸、KMnO4酸性溶液 |
用铜锌合金制成的黄铜制品常被误作黄金.下列方法不能区分其真伪的是( )
| A、观察外表 | B、放入硝酸中 |
| C、测定密度 | D、放入盐酸中 |
如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )


| A、Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
| B、简单离子的半径:X>Z>M |
| C、由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D、Z单质不能从M与R元素构成的盐溶液中置换出单质M |
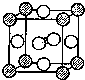 X、Y、D、E、M、N是原子序数依次增大的前四周期元素,其中X是周期表中原子半径最小的元素,Y元素基态原子的三个能级上电子数目相同,E是地壳中含量最多的元素,M是制常见不锈钢材料的第一主要合金元素,其基态原子核外的未成对电子数在同周期元素中最多,N是目前用量最大的金属元素.
X、Y、D、E、M、N是原子序数依次增大的前四周期元素,其中X是周期表中原子半径最小的元素,Y元素基态原子的三个能级上电子数目相同,E是地壳中含量最多的元素,M是制常见不锈钢材料的第一主要合金元素,其基态原子核外的未成对电子数在同周期元素中最多,N是目前用量最大的金属元素. 表示,镍原子用
表示,镍原子用 表示,镁原子用
表示,镁原子用 表示),则该晶体的化学式:
表示),则该晶体的化学式:
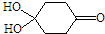 )分子间脱水而得;一定条件下,M发生1个-OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为
)分子间脱水而得;一定条件下,M发生1个-OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为
 ).
). )发生类似反应①的反应,其生成物的结构简式为
)发生类似反应①的反应,其生成物的结构简式为 已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d亚层为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d亚层为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):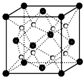 (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.