题目内容
19.下列与实验相关的叙述,正确的是( )| A. | 浓硝酸存放在带橡胶塞的棕色玻璃瓶中 | |
| B. | 四氯化碳萃取溴水中的溴时,水从分液漏斗下口流出 | |
| C. | 红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟 | |
| D. | 某溶液中滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液中一定含有Ag+ |
分析 A.浓硝酸可氧化橡胶;
B.四氯化碳的密度比水的密度大;
C.生成氯化铜固体;
D.白色沉淀可能为AgCl或硫酸钡.
解答 解:A.浓硝酸可氧化橡胶,则浓硝酸存放在带玻璃塞的棕色玻璃瓶中,故A错误;
B.四氯化碳的密度比水的密度大,则四氯化碳萃取溴水中的溴时,水从分液漏斗上口倒出,故B错误;
C.生成氯化铜固体,则红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟,故C正确;
D.白色沉淀可能为AgCl或硫酸钡,则溶液中不一定含有Ag+,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、离子检验为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
9.反应4CO(g)+2NO2(g)?N2(g)+4CO2(g)开始进行时,CO的浓度为4mol/L,N2的浓度为0,2min后测得N2的浓度为0.6mol/L,则此段时间内,下列反应速率表示正确的是( )
| A. | v(CO)=1.2 mol/(L•s) | B. | v(NO2)=0.3 mol/(L•min) | ||
| C. | v(N2)=0.6 mol/(L•min) | D. | v(CO2)=1.2 mol/(L•min) |
10.下列说法正确的是( )
| A. | 放热的反应发生时不必加热 | |
| B. | 反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 放热反应在常温下一定很容易发生 |
7.在四个不同的容器中进行化学反应4A(g)+5B(g)?4C(g)+6D(g),以下是在不同容器中分别用不同物质表示的化学反应速率,所表示反应速率最快的( )
| A. | v (A)=0.36mol•L-1•s-1 | B. | v (B)=0.55mol•L-1•s-1 | ||
| C. | v (C)=0.40mol•L-1•s-1 | D. | v (D)=0.48mol•L-1•s-1 |
14.下列说法正确的是( )
| A. | SiO2是酸性氧化物,能与NaOH溶液反应生成盐和水 | |
| B. | 实验室中用石灰水区分Na2CO3与NaHCO3两瓶无标签溶液 | |
| C. | O3和O2为同种元素组成的单质,所以O3和O2互为同位素 | |
| D. | Na2O和Na2O2组成元素相同,与H2O的反应产物也相同 |
4.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,1L 1mol/LHF溶液中含HF分子数目为NA | |
| B. | 2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-a kJ•mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量 | |
| C. | 78gNa2O2固体中含阴离子数目为NA | |
| D. | 25g质量分数68%的H2O2水溶液中含氧原子数目为NA |
11.在物质分类中,前者包括后者的是( )
| A. | 氧化物、化合物 | B. | 盐、电解质 | C. | 溶液、胶体 | D. | 分散系、溶液 |
1.乙酸是一种重要的有机原料,在化工生产和生活中有广泛的用途.某小组组装下列装置如图1由乙醇、冰醋酸和浓硫酸为原料制备乙酸乙酯,回答下列问题.
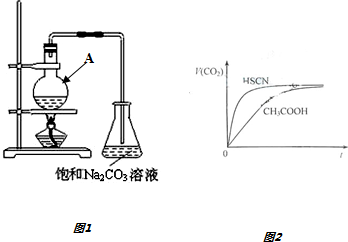
(1)仪器A的名称是圆底烧瓶.往仪器A中加入原料的正确顺序及操作是先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸.
(2)在仪器A中生成乙酸乙酯的化学反应方程式为CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(3)欲提高乙酸的转化率,可采取的措施有乙醇过量、及时分离出乙酸乙酯等.
(4)目前对该反应的催化剂进行了新的探索,初步表明质子(H+ )液体可用作该反应的催化剂,且能重复使用.实验数据如下表所示(乙酸和乙醇以等物质的量混合)
根据表中数据,下列C(填字母)为该反应的最佳条件.
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
(5)常温下,将20mL 0.10mol•L-1 CH3COOH溶液和20mL 10mol•L-1 HSCN溶液分别与20mL 0.10mol•L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图2所示,由图分析:反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快,反应结束后所得两溶液中,c(CH3COO-)<c(SCN-)(填“>”、“<”或“=”)
(6)设计一个简单的实验证明醋酸是弱酸.

(1)仪器A的名称是圆底烧瓶.往仪器A中加入原料的正确顺序及操作是先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸.
(2)在仪器A中生成乙酸乙酯的化学反应方程式为CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(3)欲提高乙酸的转化率,可采取的措施有乙醇过量、及时分离出乙酸乙酯等.
(4)目前对该反应的催化剂进行了新的探索,初步表明质子(H+ )液体可用作该反应的催化剂,且能重复使用.实验数据如下表所示(乙酸和乙醇以等物质的量混合)
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率 (%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性 (%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
(5)常温下,将20mL 0.10mol•L-1 CH3COOH溶液和20mL 10mol•L-1 HSCN溶液分别与20mL 0.10mol•L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图2所示,由图分析:反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快,反应结束后所得两溶液中,c(CH3COO-)<c(SCN-)(填“>”、“<”或“=”)
(6)设计一个简单的实验证明醋酸是弱酸.