题目内容
6.为确定某溶液的离子组成,进行如下实验:①取少量人员加Ba(NO3)2溶液,产生白色沉淀;
②然后继续加入稀盐酸至溶液呈酸性,产生无刺激性气味且能使澄清石灰水变浑浊的气体,白色沉淀部分溶解的气体;
③取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验,以下推测不正确的是( )
| A. | 一定有SO${\;}_{4}^{2-}$- | B. | 一定有CO32- | ||
| C. | 不能确定Cl-是否存在 | D. | 不能确定HCO3-是否存在 |
分析 分析进行的实验现象判断存在的离子:①取少量溶液滴加Ba(NO3)2溶液,产生白色沉淀,说明溶液中含有和钡离子生成沉淀的阴离子,可能为碳酸根离子、硫酸根离子、亚硫酸根离子等;
②然后继续加入稀盐酸,若存在碳酸氢根,就会立即产生气体,而实验中是滴加一定时间后才产生气体,说明溶液中无大量的碳酸氢根,溶液在酸性条件下,若存在亚硫酸根离子,亚硫酸根离子生成的亚硫酸钡沉淀被氧化为硫酸钡沉淀,产生无刺激性气味且能使澄清石灰水变浑浊的无色气体;白色沉淀部分溶解,说明沉淀中包含碳酸钡沉淀和硫酸钡沉淀;
③取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀,是生成了氯化银白色沉淀,但②步骤中加入了盐酸含有氯离子,所以不能确定原溶液中是否含有氯离子.
解答 解:分析进行的实验现象判断存在的离子:①取少量溶液滴加Ba(NO3)2溶液,产生白色沉淀,说明溶液中含有和钡离子生成沉淀的阴离子;②然后继续加入稀盐酸,若存在碳酸氢根,就会立即产生气体,而实验中是滴加一定时间后才产生气体,说明溶液中无大量的碳酸氢根,溶液呈酸性,产生无刺激性气味且能使澄清石灰水变浑浊的无色气体;白色沉淀部分溶解,说明沉淀中一定含有碳酸钡沉淀和硫酸钡沉淀;③取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀,是生成了氯化银白色沉淀,但②步骤中加入了盐酸含有氯离子,所以不能确定原溶液中是否含有氯离子;综上所述,溶液中含有碳酸根离子和硫酸根离子,不能确定是否含氯离子,一定不含碳酸氢根离子.
A.一定能含有硫酸根离子,故A正确;
B.依据反应现象分析可知一定含有碳酸根离子,故B正确;
C.步骤中加入盐酸含有氯离子,所以氯离子不能确定,故C正确;
D.继续加入稀盐酸,若存在碳酸氢根,就会立即产生气体,而实验中是滴加一定时间后才产生气体,说明溶液中无大量的碳酸氢根,故D错误;
故选D.
点评 本题为实验题,本题考查了离子检验的方法和现象分析,明确各种离子的特性和反应后的特殊现象,排除干扰离子是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 氧化 | B. | 水解 | C. | 加成 | D. | 酯化 |
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
| A. | 氯化亚铁溶液中通入少量氯气:Fe2++Cl2→Fe3++2Cl? | |
| B. | 向偏铝酸钠溶液中通入过量的CO2:AlO2-+2H2O+CO2→Al(OH)3↓+HCO3- | |
| C. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O→AlO2-+4NH4++2H2O | |
| D. | 向氢氧化铝中加入稀硫酸:2Al(OH)3+6H+→2Al3++6H2O |


 +
+ $→_{△}^{稀OH-}$
$→_{△}^{稀OH-}$ +H2O
+H2O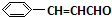 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2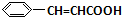 +H2O;③C与F的反应:
+H2O;③C与F的反应: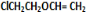 +
+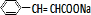 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$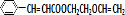 +NaCl.
+NaCl.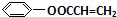 .
. ,⑤的电子式是
,⑤的电子式是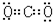 .
.