题目内容
15.用脱脂棉花包住约0.2g 过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉花剧烈燃烧起来.由实验现象所得出的有关Na2O2和H2O反应的结论是:a.反应放出大量热;
b.有氧气生成.
Na2O2和H2O反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
分析 (1)燃烧的条件是:①物质具有可燃性,②可燃物与氧气接触,③温度达到可燃物的着火点,根据燃料燃烧的条件分析;
(2)过氧化钠和水反应生成氢氧化钠和氧气.
解答 解:( 1)脱脂棉燃烧需要氧气,且温度达到着火点,说明过氧化钠与水反应,有氧气生成,同时发出大量的热,该反应为放热反应,
故答案为:氧气;
(2)过氧化钠和水反应生成氢氧化钠和氧气,方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑.
点评 本题以可燃物燃烧的条件为载体,考查过氧化钠的性质,侧重对学生根据实验现象分析归纳能力考查,比较基础.

练习册系列答案
相关题目
20.下列图示实验或图象错误的是( )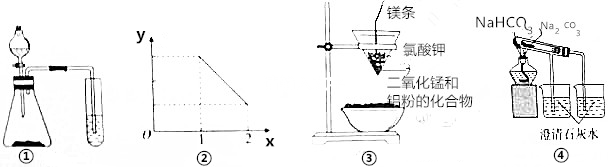

| A. | 用图①装置可比较硫酸、碳酸、硅酸三者的酸性强弱 | |
| B. | 图②表示NO2溶于水完全转化为HNO3时,水(x)与消耗氧气的物质的量(y)之间 关系 | |
| C. | 图③装置可制得金属锰 | |
| D. | 图④装置可验证NaHCO3和NaCO3的热稳定性 |
7.已知某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是( )
| A. | Al3+、CH3COO-、Cl- | B. | Mg2+、Ba2+、Br- | ||
| C. | Mg2+、Cl-、I- | D. | Na+、NH4+、Cu2+ |
4.将a g二氧化锰粉末加入cL b mol•L-1的浓盐酸中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 可以收集到氯气$\frac{22.4b}{2{N}_{A}}$L | |
| B. | 反应后溶液中的Cl-数目为(bc•NA-2d) | |
| C. | NA可表示为$\frac{87d}{2a}$ | |
| D. | 反应后溶液中的H+数目为(bc-2d) |
 A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).

 .
.