题目内容
6.今年来,雾霾天气多次肆虐北京、天津地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)△H<0
①该反应的平衡常数表达式K=$\frac{{c}^{2}(C{O}_{2})c({N}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$
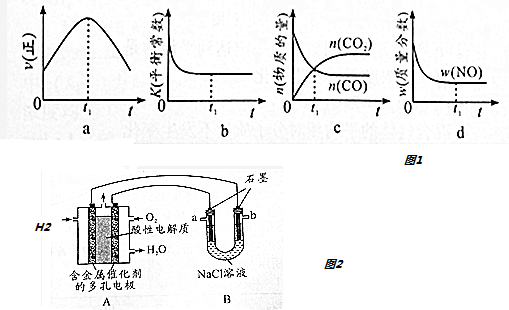
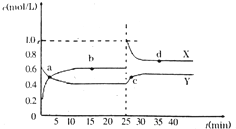
②若该反应在恒容的密闭体系中进行,下列示意图如图1正确且能说明该反应进行到t1时刻达到平衡状态的是b、d (填代号)
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染.
例如:
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol
2NO2(g)?N2O4(g)△H2=-56.9kJ/mol
H2O(g)═H2O(l)△H3=-44KJ/mol
写出CH4 (g)催化还原N2O4(g)生成N2 (g)和H2O (l)的热化学方程式CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(l)△H═-898.1kJ/mol.
(3)甲烷燃料电池可以提升能量利用率.图2是利用甲烷燃料电池电解100ml 1mol/L食盐水的装置,电解一段时间后,收集到标准状况下的氢气1.12L(设电解后溶液体积不变)
①甲烷燃料电池的负极反应式为CH4-8e-+2H2O=CO2+8H+
②电解后溶液的PH=14(忽略氯气与氢氧化钠溶液).
分析 (1)①化学平衡常数=$\frac{生成物平衡浓度系数次幂的乘积}{反应物平衡浓度系数次幂的乘积}$,
②a、到达平衡后正、逆速率相等,不再变化;
b、到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
c、t1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
d、到达平衡后各组分的含量不发生变化;
(2)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式;
(3)①原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+;
②根据电解氯化钠溶液的电解方程式来求溶液的pH.
解答 解:(1)①化学平衡常数=$\frac{生成物平衡浓度系数次幂的乘积}{反应物平衡浓度系数次幂的乘积}$,2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g),所以K=$\frac{{c}^{2}(C{O}_{2})c({N}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$,
故答案为:K=$\frac{{c}^{2}(C{O}_{2})c({N}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$,
②a、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故a错误;
b、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故b正确;
c、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故c错误;
d、NO的质量分数为定值,t1时刻处于平衡状态,故d正确,
故答案为:bd;
(2)已知:①CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol
②2NO2(g)?N2O4(g)△H2=-56.9kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
根据盖斯定律,①-②+③×2得:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l),
故△H=-867kJ/mol-(-56.9kJ/mol)-44.0kJ•mol-1×2=-898.1kJ/mol,
即CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l),△H=-898.1kJ/mol,
故答案为:CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(l)△H═-898.1kJ/mol;
(3)①原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+,负极电极反应式为:CH4-8e-+2H2O=CO2+8H+,
故答案为:CH4-8e-+2H2O=CO2+8H+;
②电解一段时间后,收集到标准状况下的氢气1.12L
由方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$ 2NaOH+H2↑+Cl2↑
2 2 22.4
0.1L×1mol/L n(NaOH) 1.12L
NaCl刚好电解完,n(NaOH)=0.1mol,c(OH-)=0.1mol÷0.1L=1mol/L,C(H+)=$\frac{{K}_{W}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{1mol•{L}^{-1}}$=10-14mol•L-1,所以pH=14,
故答案为:14.
点评 本题考查了盖斯定律求焓变、化学平衡影响因素,化学反应速率,平衡常数概念计算应用,原电池电解池原理的分析应用,注意平衡的条件分析,题目综合性强.

 灵星计算小达人系列答案
灵星计算小达人系列答案| A. | KMnO4溶液 | B. | NaClO溶液 | C. | 饱和NaHCO3溶液 | D. | 饱和Na2CO3溶液 |
 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | H+、NH+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
①则该溶液中一定不含有的离子是H+、NH4+、Al3+;
②可能存在的阳离子有K+;
③肯定不存在的阴离子是ClO-、AlO2-.
(2)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向2L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题.
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
②当通入Cl2的体积为3.36L(标准状态下)时,溶液中发生反应的离子方程式为Cl2+2I-=2Cl-+I2;此时溶液中Br-、I-的物质的量浓度分别为c(Br-)=0.75mol/L,c(I-)=0.05mol/L.
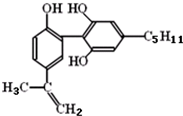
| A. | 该分子中所有碳原子一定共存于同一平面内 | |
| B. | 1mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4mol、7mol | |
| C. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| D. | 滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在碳碳双键 |
| A. | 单质碘 | B. | 氯化钠 | C. | 水 | D. | 氢气 |
 X、Y、Z、W、Q五种元素的原子序数依次增大,X、Y、Z、W属于短周期元素.已知X位于周期表的s区,其原子中电子层数和未成对电子数相同;Y原子核外有三个能级,且每个能级上容纳的电子数相同;W原子最外层电子数是次外层电子数的3倍;Q元素的原子核外有26个运动状态完全不相同的电子.回答下列问题:
X、Y、Z、W、Q五种元素的原子序数依次增大,X、Y、Z、W属于短周期元素.已知X位于周期表的s区,其原子中电子层数和未成对电子数相同;Y原子核外有三个能级,且每个能级上容纳的电子数相同;W原子最外层电子数是次外层电子数的3倍;Q元素的原子核外有26个运动状态完全不相同的电子.回答下列问题: