题目内容
5.已知A、B、C、D和E,五种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子.又知B、C和D是由两种元素的原子组成.下列说法正确的是( )| A. | A分子的原子的核外电子排布式是1s22s22p63s23p4 | |
| B. | 向D的溶液中加入少量二氧化锰,一定有无色气体生成. | |
| C. | 还原性强弱B>C | |
| D. | 若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是CH4O |
分析 在18电子分子中,单原子分子A为Ar,B、C和D是由两种元素的原子组成,双原子分子B为HCl,三原子分子C为H2S,四原子分子D为PH3或H2O2,若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,根据燃烧规律可知E为CH4Ox,故6+4+8x=18,所以x=1,E的分子式为CH4O,据此解答.
解答 解:在18电子分子中,单原子分子A为Ar,B、C和D是由两种元素的原子组成,双原子分子B为HCl,三原子分子C为H2S,四原子分子D为PH3或H2O2,
A.Ar原子核外电子数为18,原子核外电子排布式为1s22s22p63s23p6,故A错误;
B.D为PH3或H2O2,若为H2O2时,加入少量二氧化锰,有无色气体生成,为PH3时,没有气体生成,故B错误;
C.由于非金属性Cl>S,故还原性HCl<H2S,故C错误;
D.1mol E在氧气中完全燃烧,只生成1mol CO2和2mol H2O,根据燃烧规律可知E为CH4Ox,故6+4+8x=18,所以x=1,E的分子式为CH4O,故D正确,
故选:D.
点评 本题考查无机物的推断、分子结构与性质等,难度不大,注意掌握常见10电子、18电子微粒.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
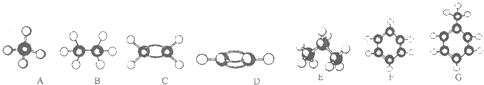
15. 如图是两种有机分子的比例模型(
如图是两种有机分子的比例模型( 表示碳原子,
表示碳原子, 表示氢原子,
表示氢原子, 表示氧原子,下列有关叙述不正确的是( )
表示氧原子,下列有关叙述不正确的是( )
 如图是两种有机分子的比例模型(
如图是两种有机分子的比例模型( 表示碳原子,
表示碳原子, 表示氢原子,
表示氢原子, 表示氧原子,下列有关叙述不正确的是( )
表示氧原子,下列有关叙述不正确的是( )| A. | 甲、乙都含有羧基 | |
| B. | 甲、乙两物质都能和活泼金属钠反应放出H2 | |
| C. | 甲可以在一定条件下和乙反应生成酯 | |
| D. | 甲、乙两物质的分子式分别为C3H6O3、C2H602 |
16.要除去下表所列有机物中的杂质(括号内为杂质),从(1)中选择适宜的试剂,从(2)中选择分离提纯的方法,用序号填入表中.
(1)试剂:a.溴水 b.氢氧化钠溶液 c.碳酸钠溶液 d.生石灰 e.酸性高锰酸钾溶液
(2)方法:A.过滤 B.分液 C.蒸馏 D.洗气
(1)试剂:a.溴水 b.氢氧化钠溶液 c.碳酸钠溶液 d.生石灰 e.酸性高锰酸钾溶液
(2)方法:A.过滤 B.分液 C.蒸馏 D.洗气
| 要提纯的物质 (杂质) | 乙烷 (乙烯) | 乙酸乙酯 (乙酸) | 乙醇 (水) | 溴苯 (溴) |
| 选用试剂 | ||||
| 分离方法 |
13.若NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 13g乙炔(C2H2)总原子数为2NA | |
| B. | 4℃时9mL水和11.2L氮气含有相同的分子数 | |
| C. | 同温同压下,NA个NO2与NA个N2的体积相等 | |
| D. | 标准状况下,11.2 L氧气所含的原子数目为NA |
17.下列反应中,反应后固体物质增重的是( )
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | CO高温下还原Fe2O3 | D. | 将锌粒投入Cu(NO3)2溶液 |
14.下列实验操作正确的是( )
| A. | 用玻璃棒蘸取CH3COOH溶液,点在用水湿润的pH试纸上测定其pH | |
| B. | 用25ml碱式滴定管量取20.00 mL KMnO4溶液 | |
| C. | 为除去苯中的少量苯酚,向混合物中加入适量的氢氧化钠后分液 | |
| D. |  用如图装置加热分解NaHCO3 |
 .
. ,该反应属于取代反应类型.
,该反应属于取代反应类型.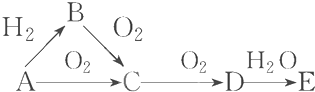
 (1)写出由甲苯制备TNT的化学反应方程式
(1)写出由甲苯制备TNT的化学反应方程式 .
. ;Y的结构简式为:
;Y的结构简式为: .
.